
| A. | 23gNa与氧气充分燃烧,转移的电子数为NA | |
| B. | 1mol甲醇中含有的共价键数为4NA | |
| C. | 46gNO2和N2O4的混合气体含有的原子数为2NA | |
| D. | 标准状况下,22.4L氨水含有NH3分子数为NA |
分析 A、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
B、甲醇中含有3条C-H键和1条C-O键和1条O-H键;
C、NO2和N2O4的最简式均为NO2;
D、标况下氨水为液体.
解答 解:A、23g钠的物质的量为1mol,而钠反应后变为+1价,故1mol钠失去1mol电子即NA个,故A正确;
B、甲醇中含有3条C-H键和1条C-O键和1条O-H键,故1mol甲醇中含有5NA条共价键,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有NO2的物质的量为1mol,故含3NA个原子,故C错误;
D、标况下氨水为液体,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将等体积的④、⑤分别加蒸馏水稀释至pH=6,加入水的体积:④>⑤ | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,得到的溶液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
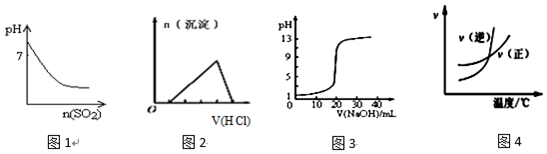
| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
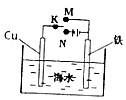
| A. | 电泳现象可证明胶体带电 | |
| B. | 如图装置,无论电键K接M还是接N,铁都能得到保护 | |
| C. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | 由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中能发生反应的离子方程为;2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
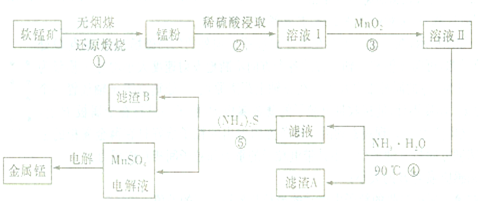
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
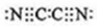 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com