
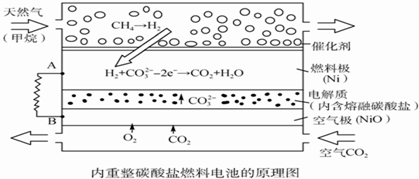
| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
分析 该燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,根据图示信息知道负极电极反应式为:H2-2e-+CO32-=CO2+H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-,
A、依据电子守恒结合电极反应计算得到;
B、原电池的负极上发生失电子的氧化反应;
C、根据得失电子守恒,分析判断碳酸离子浓度的变化情况;
D、空气极是氧气得到电子,生成碳酸根离子的反应.
解答 解:A、电解精炼铜,阴极上铜离子得到电子生成铜,电极反应Cu2++2e-=Cu,当电路有0.1mol e-转移反应生成铜0.05mol,如果全部是铜放电,则溶解的铜的质量=0.05mol×64g/mol=3.2g,粗铜有比铜更活泼的金属首先放电,所以溶解的铜小于3.2g,故A错误;
B、根据图示信息,通入甲烷的电极是负极,在负极上,甲烷发生失电子的氧化反应,即CH4+5O2--8e-═CO32-+2H2O,故B正确;
C、假设转移4mol的电子,根据电极反应:负极电极反应式为:H2-2e-+CO32-=CO2+H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-,负极消耗2mol的碳酸根离子,正极产生2mol的碳酸根离子,所以碳酸根离子的浓度不变,无需补充Li2CO3和K2CO3,故C错误;
D、原电池正极上的电极反应式为O2+4e-+2CO2=2CO32-,故D正确;
故选:BD.
点评 本题考查了图象分析判断的方法应用,原电池原理的分析判断和电极反应的分析判断,掌握基础是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测食盐水的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所取溶液体积偏小 | |
| D. | 中和滴定实验时,锥形瓶先用蒸馏水再用待测液润洗,所测溶液浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4与NaAlO2组成的混合物 | B. | KAl(SO4)2 | ||
| C. | Al2(SO4)3 | D. | NH4Al(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、N2 | B. | H2、N2、O2 | C. | CO2、Cl2、HCl | D. | SO2、O2、H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com