
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.分析 (1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反应②;
(3)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
(4)反应热=反应物的总键能-生成物的总键能,以此解答.
解答 解:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反应②,则△H2=+49.0kJ•mol-1+(-241.8kJ•mol-1)=-192.8kJ•mol-1,故答案为:-192.8kJ•mol-1;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,正极电极反应为O2+4H++4e-=2H2O,
故答案为:负;O2+4H++4e-=2H2O.
(4)已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92kJ/mol,
解得:x=945.6 kJ/mol,故答案为:945.6 kJ/mol.
点评 本题为综合题,涉及反应热的计算、热化学反应方程式的书写、燃料电池等知识点,注重高考常考考点的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2发生还原反应 | B. | H2是还原剂 | C. | Cl2被氧化 | D. | Cl2发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
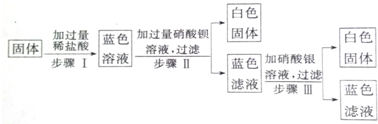
 在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题:
在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
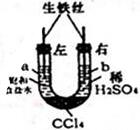 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 油脂是高级脂肪酸的甘油酯,均不能发生氢化反应 | |
| C. | H2N-CH2-COOH既能与盐酸反应、又能与氢氧化钠溶液反应 | |
| D. | 合成橡胶 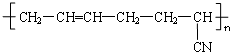 的单体之一是CH3-C≡C-CH3 的单体之一是CH3-C≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操 作 | 现 象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有的离子是①③⑥ | B. | 肯定没有的离子只有② | ||
| C. | 不能确定的离子只有⑤ | D. | 肯定含有的离子是①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com