
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
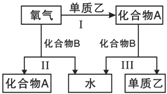
![]() 如图三个反应中,属于氧化还原反应的有______个.
如图三个反应中,属于氧化还原反应的有______个.
![]() 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
A.还原性:![]() B.酸性:
B.酸性:![]()
C.稳定性:![]() C.沸点:
C.沸点:![]()
![]() 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性![]() 答题必须用具体物质表示
答题必须用具体物质表示![]() .
.
![]() 化合物B的电子式为______;其水溶液呈碱性的原因是______
化合物B的电子式为______;其水溶液呈碱性的原因是______![]() 用离子方程式表示
用离子方程式表示![]() .
.
![]() 化合物B可与
化合物B可与![]() 组成燃料电池
组成燃料电池![]() 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液![]() ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
![]() 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为![]() 和
和![]() ,则反应Ⅰ的热化学方程式为______
,则反应Ⅰ的热化学方程式为______![]() 注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体![]() .
.
【答案】3 A、C ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
![]() 、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应;
、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应;
![]() 元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律判断;
元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律判断;
![]() 若化合物B常温下为气体,其水溶液呈碱性,则B为
若化合物B常温下为气体,其水溶液呈碱性,则B为![]() ,根据转化关系可知,A为NO,乙为
,根据转化关系可知,A为NO,乙为![]() ,据此答题。
,据此答题。
![]() 、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应,所以属于氧化还原反应的有Ⅰ、Ⅱ、Ⅲ,共3个;
、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应,所以属于氧化还原反应的有Ⅰ、Ⅱ、Ⅲ,共3个;
![]() 元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律可知,能说明S与氧的非金属性相对强弱的有,还原性:
元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律可知,能说明S与氧的非金属性相对强弱的有,还原性:![]() 、稳定性:
、稳定性:![]() ,故答案为:A、C;
,故答案为:A、C;
![]() 若化合物B常温下为气体,其水溶液呈碱性,则B为
若化合物B常温下为气体,其水溶液呈碱性,则B为![]() ,根据转化关系可知,A为NO,乙为
,根据转化关系可知,A为NO,乙为![]() ;
;
![]() 化合物B的电子式为
化合物B的电子式为![]() ;其水溶液呈碱性的原因是一水合氨电离产生氢氧根离子,离子方程式为
;其水溶液呈碱性的原因是一水合氨电离产生氢氧根离子,离子方程式为![]()
![]()
![]() ;
;
![]() 化合物
化合物![]() 与
与![]() 组成燃料电池
组成燃料电池![]() 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液![]() ,电池负极为氨气发生氧化反应生成氮气和水,电极反应式为
,电池负极为氨气发生氧化反应生成氮气和水,电极反应式为![]() ;
;
![]() 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为![]() 和
和![]() ,根据盖斯定律,将反应反应
,根据盖斯定律,将反应反应![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() 可得反应Ⅰ的热化学方程式为
可得反应Ⅰ的热化学方程式为![]() 。
。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.金刚石中C—C键的键长为154.45 pm, C60中C—C键的键长为 140~ 145 pm,所以C60的熔点高于金刚石
B.CO2晶体是分子晶体,SiO2晶体也是分子晶体
C.从CH4 、![]() 、
、![]() 为正面体结构,可推测CC14、
为正面体结构,可推测CC14、![]() 、
、![]() 也为正四面体结构
也为正四面体结构
D.H2O常温下为液态,H2S常温下也为液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是![]()
A.![]() 溶液与烧碱溶液反应,当
溶液与烧碱溶液反应,当![]() :
:![]() :2时,
:2时,![]()
B.当向饱和![]() 溶液中通入过量
溶液中通入过量![]() 时,
时,![]()
C.![]() 与NaHS溶液反应,当
与NaHS溶液反应,当![]() :
:![]() :2时,
:2时,![]() 十
十![]()
D.Fe与稀硝酸反应,当![]() :
:![]() :2时,
:2时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)在室温下,纯净的氮化镁(Mg3N2)为黄绿色的粉末,能与水反应,常用作触媒,实验室用如图1所示装置和药品制备少量氮化镁。
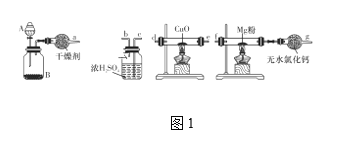
①A中盛装的是____,B中可盛装碱石灰,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接____、____接____、_b__接____。
③气体通过CuO这一装置的目的是什么?用化学方程式回答:______。
④无水氯化钙装置可防止外界空气中的水进入,以防_____________(化学方程式表示)的发生。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。
Ⅰ.合成碳酸镁晶体的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到产品碳酸镁晶体(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____。
②步骤3中加氨水后发生反应的离子方程式为________________
Ⅱ.测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶体,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶体反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
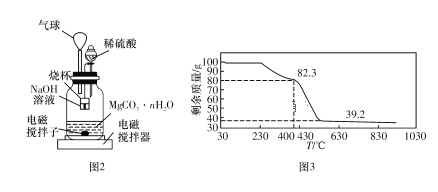
③上述反应后期要升温到30 ℃,主要目的是_____________________
④若实验测得1.000 g碳酸镁晶体产生CO2的平均物质的量为a mol,则n为__________(用含a的表达式表示)。
⑤若称取100 g上述晶体进行热重分析,得到的热重曲线如图3所示,则合成的晶体中n=____(取整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
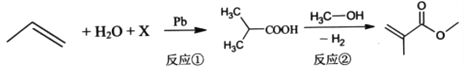 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是![]()
A.铝片放入NaOH溶液中有气体产生:![]()
B.泡沫灭火器灭火的原理:![]()
C.氨水吸收少量![]() 防止污染空气:
防止污染空气:![]()
D.“84”消毒液中滴少量白醋可增强漂白性:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com