
| n(H2O) |
| n(CH4) |
| n(H2O) |
| n(CH4) |
| ��c |
| ��t |
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
| ||
| 6min |
| 0.8��2��43 |
| 0.2��0.2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=0����Һ�У�Na+��[Al��OH��4]-��K+��NH4+ |
| B����ˮ�������c��H+��=10-12mol?L-1����Һ�У�C1-��HCO3-��NH4+��SO32- |
| C�������������H2����Һ�У�Mg2+��NH4+��Cl-��SO42- |
| D���μ�ʯ����Һ����ɫ����Һ��K+��Ba2+��NO3-��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����NA�������ӵ��������������22.4L |
| B��Na2O2��H2O��Ӧ��O2��ÿ����1 mol O2ת��4NA������ |
| C��1mol CH3OH��ȼ�ϵ�ظ���������Ӧʱ�õ�4NA������ |
| D��O��O1mol Mg�ڿ�������ȫȼ�գ�����MgO��Mg3N2��ת�Ƶ�������0.02NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
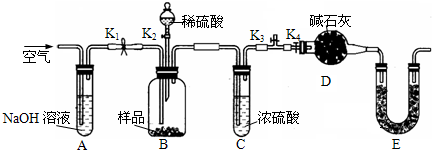
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu��OH��2��CuCO3��CuS |
| B��CuS��Cu��OH��2��CuCO3 |
| C��CuS��Cu��OH��2��CuCO3 |
| D��Cu��OH��2��CuCO3��CuS |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��RCl��RI��R2CrO4 |
| B��RCl��R2CrO4��RI |
| C��R2CrO4��RCl��RI |
| D��R2CrO4��RI��RCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com