

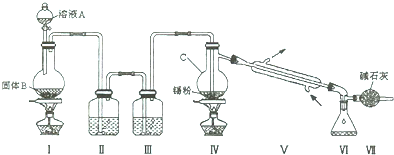
分析 足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4.
(1)根据常用仪器的名称和用途解答;恒压滴液漏斗漏斗支管可以平衡内外压强,使液体顺利滴下;足量Cl2通入和KOH溶液中,温度低时发生反应生成次氯酸根离子;
(2)KOH和氯气在低温下反应生成KClO,只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,再往仪器a中加入浓KOH溶液的目的是与过量的Cl2继续反应,生成更多的KClO,氯气为黄绿色气体,判断浓KOH溶液已过量三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
(3)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)①加入饱和KOH溶液可以增大氢氧根离子的浓度,使平衡向左移动;
②只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净;
(5)用电解法制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水.
解答 解:(1)仪器a属于烧瓶,具有三个口,名称是三颈烧瓶,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,2KOH+Cl2=KCl+KClO+H2O(条件:较低温度),所以两水槽中的水为冷水,
故答案为:三颈烧瓶;平衡压强;冷水;
(2)只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,KOH和氯气反应生成KClO,所以加入KOH的目的是除去氯气且使溶液为后一步反应提供碱性,氯气为黄绿色气体,判断浓KOH溶液已过量三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾,
故答案为:与过量的Cl2继续反应,生成更多的KClO;三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒:Fe(+3→+6),Cl(+1→-1),最小公倍数为6,所以Fe3+、FeO42-前系数都为2,ClO-、Cl-,前系数都为3,结合质量守恒和电荷守恒可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)①K2FeO4 在水溶液中易水解:4FeO42-+10H2O?4Fe(OH)3(胶体)+8OH-+3O2↑,加入饱和KOH溶液可以增大氢氧根离子的浓度,使平衡向左移动,抑制FeO42-的水解,
故答案为:增大氢氧根离子的浓度,抑制FeO42-的水解;
②K2FeO4晶体表面若含有杂质离子为氯离子,所以只要检验最后一次的洗涤中无Cl-,即可证明晶体已经洗涤干净,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸酸化的硝酸银溶液,若无白色沉淀则已被洗净;
(5)用铁做阳极电解氢氧化钠制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,侧重考查学生分析能力、知识迁移运用能力,题目难度中等.培养了学生运用知识的能力.


科目:高中化学 来源: 题型:解答题
 N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个固定容积的密闭容器中充入1mol N2和3mol H2使反应N2(g)+3H2(g)?2NH3(g)达到平衡,测得反应放出热量为Q1kJ.
N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个固定容积的密闭容器中充入1mol N2和3mol H2使反应N2(g)+3H2(g)?2NH3(g)达到平衡,测得反应放出热量为Q1kJ.查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
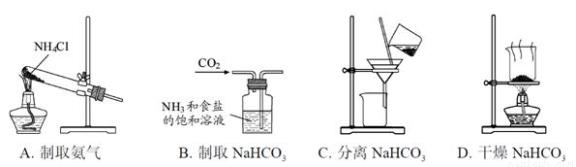
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
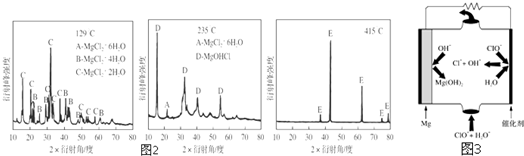
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

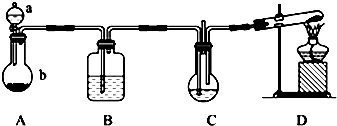
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2 | |
| C. | 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓ | |
| D. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com