
| A、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B、用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
| C、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
| D、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol?L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④>②>③ |
| 1 |
| 10 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
| B、标准状况下,22.4LH2O含有的分子数为1 NA |
| C、5.6g的Fe和足量的盐酸反应时,失去的电子数为0.2 NA |
| D、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
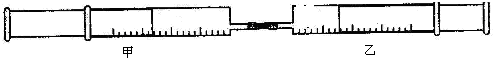
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒现象 |
| 1 | 10mlFeSO4 | 10mlNH3 | 生成白色沉淀,后变色 |
| 2 | 15mlCl2 | 40mlNH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
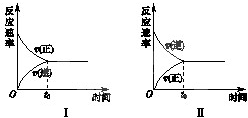 t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示:
t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 离子方程式或电极反应式 | 评价 | |
| A | 次氯酸钙溶液中通入足量SO2 | Ca2++ClO-+SO2+H2O=CaSO4+Cl-+2H+ | 正确 |
| B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ | 正确 |
| C | 醋酸铵溶于水 | CH4COO-+NH4++2H2O?CH3COOH+NH3?H2O | 错误,阴离子水解相互促进,应该用“=”号 |
| D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e-=2Cu 阳极:4OH--4e-=2H2O+O2↑ | 错误,该阴阳两极反应不可能同时发生 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、NO3-、Cl- |
| B、Na+、Zn2+、OH-、Br- |
| C、K+、SO42-、Cl-、Mg2+ |
| D、Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHB溶液不一定呈酸性,Na2B溶液不一定呈碱性 |
| B、在Na2B溶液中一定有:c(Na+)=2c(B2-)+c(HB-)+c(H2B) |
| C、NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-) |
| D、在Na2B溶液中一定有:2c(OH-)=c(H+)+c(HB-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com