
 ,故答案为:
,故答案为: ;
;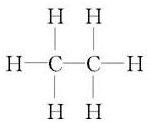 ,故答案为:
,故答案为: ;
;

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| A、1 mol O2 的质量为 32 g/mol |
| B、SO42-的摩尔质量是 96 g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量是44 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na2O2含有的阴离子数目为0.2NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、25℃时,1.0L pH=9的CH3COONa溶液中H+和CH3COOH的总数目为10-5NA |
| D、己知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将2NA 个SO2分子和NA 个O2,分子置于一密闭容器中充分反应后放出QkJ的 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:| 序号 | 气体 | 反应原理 | A中试剂 |
| ① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | |
| ② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是 | NaOH溶液 |
| ③ | 乙炔 | 电石与饱和食盐水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
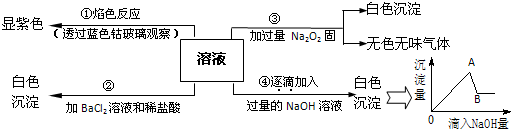
查看答案和解析>>
科目:高中化学 来源: 题型:
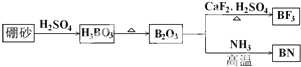
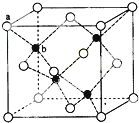
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com