
| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |
分析 A、根据晶胞结构判断配位数;
B、根据两种离子所在位置,利用空间想象能力判断;
C、K+位于晶胞棱心,根据其位置判断距离相等且最近的K+数目;
D、利用均摊法计算.
解答 解:A、K+位于晶胞棱心,与K+距离相等且最近的O2-位于顶点和面心,共有6个,故A错误;
B、与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,故B正确;
C、K+位于晶胞棱心,则被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4×3=12个,故C错误;
D、K+位于晶胞棱心和体心,数目为12×$\frac{1}{4}$+1=4,O2-位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即一个KO2晶胞中摊得的K+和O2-粒子数均为4个,故D错误;
故选B.
点评 本题考查晶胞计算和配位数,难度不大,要求学生有一定的空间想象能力.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为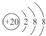 ,NH4Cl的电子式为 ,NH4Cl的电子式为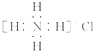 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 将1molPbS冶炼成Pb理论上至少需要6g碳 | |
| D. | 整个冶炼过程中,制取1molPb共转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com