
现有等物质的量组成的Fe、Cu合金共0.1 mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,已知硝酸的还原产物只有NO。由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法正确的是
A.根据溶液中的金属离子和残留固体的成分最多会有5种情况
B.若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解
C.当合金刚好溶解时,在标准状况下产生2.24LNO
D.若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g
D
【解析】
试题分析:A.由于混合粉末中Fe、Cu是等物质的量混合,由于二者的物质的量的和是0.1 mol,所以n(Fe)=n(Cu)=0.05mol。Fe是变价金属,可能存在的化合价有+2、+3价。若硝酸不足量,金属不能完全反应,由于Fe>Cu,则剩余金属是Cu,溶液成分可能是Fe(NO3)2;也可能是Fe(NO3)2、Cu(NO3)2;若剩余金属是Fe、Cu,溶液成分可能是Fe(NO3)2;若固体没有剩余,可能溶液的成分是Fe(NO3)2、Cu(NO3)2;Fe(NO3)3、Fe(NO3)2、Cu(NO3)2;Fe(NO3)3、Cu(NO3)2;所以可能存在的情况有6种,选项A错误;B.若金属有剩余,由于在溶液中含有NO3-,在溶液中再滴入稀硫酸后,在酸性条件下,H+、NO3-、Cu或Fe会发生反应而使金属溶解,错误;C.当合金刚好溶解时,根据A可知,溶液可能是Fe(NO3)2、Cu(NO3)2;Fe(NO3)3、Fe(NO3)2、Cu(NO3)2;Fe(NO3)3、Cu(NO3)2;由于Fe、Cu的物质的量都是0.05mol。若溶液是Fe(NO3)2、Cu(NO3)2;则根据电子守恒可得,n(NO)= [(0.05mol×2)+ (0.05mol×2)]÷3=0.2/3,体积为V(NO)=0.2mol/3×22.4L/mol=1.49L;若溶液为Fe(NO3)3、Cu(NO3)2;n(NO)= [(0.05mol×3)+ (0.05mol×2)]÷3=0.25/3,体积为V(NO)=0.25mol/3×22.4L/mol=1.87L;若产物是Fe(NO3)3、Fe(NO3)2、Cu(NO3)2;,则产生的气体的物质的量在1.49L——1.87L之间,所以选项C错误;D.若合金全部溶解,在溶液中加入过量的氨水,铜离子可转化为溶于水的四氨合铜络离子,Fe元素这形成Fe(OH)2、Fe(OH)3沉淀,经过滤、洗涤、干燥、充分灼烧得到Fe2O3,根据Fe元素守恒可知,n(Fe2O3)= 0.025mol,m(Fe2O3)= 0.025mol×160g/mol= 4g,正确。
考点:考查Fe、Cu的混合物与酸反应的情况及相应的计算的判断的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列实例没有应用蛋白质变性的是
A.重金属盐中毒的病人服用鸡蛋清解毒
B.高温消毒医疗器械
C.用甲醛的水溶液保存标本
D.把生理盐水静脉注射到人体内
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
在物质分类中,前者包括后者的是
A.氧化物、化合物 B.化合物、电解质
C.溶液、胶体 D.溶液、分散系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下列关于电化学知识说法正确的是
A.电解AlCl3溶液,在阴极上析出金属Al
B.氢氧燃料电池中,氧气是正极反应物
C.用惰性电极电解CuSO4溶液一段时间,溶液酸性不变
D.铅蓄电池在充电时,连接电源正极的电极反应为:PbSO4+2e-=== Pb+SO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
① 4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
② 2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
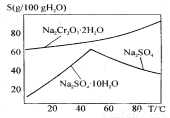
从Na2Cr2O7和 Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是
A.门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在
B.铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子
C.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高
D.Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下述实验设计能够达到目的的是
编号 | 实验目的 | 实验设计 |
A. | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
B. | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
C. | 检验溶液中是否含有Fe2+ | 向溶液中滴人氯水水后,再滴加KSCN 溶液 |
D. | 证明H2CO3酸性比H2SiO3强 | 将CO2通人Na2SiO3溶液中 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 = HCO3-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- = CaCO3↓+ CO32-+ 2H2O
C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 = 2Fe3++6Cl-+2Br2
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-= BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca (OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com