
【题目】25°C向![]() 中滴加
中滴加![]() 过程中,
过程中,![]() 变化如图所示。
变化如图所示。

(1)A点溶液![]() ,用化学用语解释原因:_________________。
,用化学用语解释原因:_________________。
(2)下列有关B点溶液的说法正确的是_______________(填字母序号)。
a. 溶质为:![]()
b. 微粒浓度满足:![]()
c. 微粒浓度满足:![]()
(3)![]() 两点水的电离程度:
两点水的电离程度:![]() ______
______![]() (填“
(填“![]() ”、“
”、“ ![]() ”或“
”或“![]() ”)。
”)。
【答案】![]() ab
ab ![]()
【解析】
(1)![]() 是弱电解质,用化学用语解释溶液
是弱电解质,用化学用语解释溶液![]() 即写出
即写出![]() 电离的方程式;
电离的方程式;
(2)B点加入的![]() 的物质的量为
的物质的量为![]() 的一半,故溶质为
的一半,故溶质为![]() 和
和![]() ,且物质的量之比为1:1;
,且物质的量之比为1:1;
(3)酸和碱会抑制水的电离,大部分能水解的盐促进水的电离;
(1)![]() 是弱电解质,在溶液中部分电离,导致氢离子浓度小于
是弱电解质,在溶液中部分电离,导致氢离子浓度小于![]() ,溶液
,溶液![]() 。其电离的方程式为:
。其电离的方程式为:![]() ;
;
(2)B点溶液:
a. ![]() 和
和![]() 物质的量之比为1:1,故a正确;
物质的量之比为1:1,故a正确;
b.由电荷守恒可知,溶液中存在:![]() ,故b正确;
,故b正确;
c. 由物料守恒(原子守恒)可知,溶液中存在:![]() ,故c错误;
,故c错误;
(3)酸和碱会抑制水的电离,大部分能水解的盐促进水的电离,A点的酸性溶液抑制水的电离,C点为醋酸和醋酸钠的混合溶液,因为PH=7,醋酸的抑制作用与醋酸钠的促进作用相互抵消,对水的电离无影响,故水的电离程度:A<C;


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
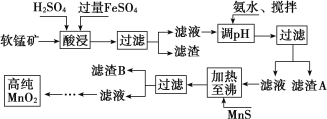
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.MgH2拥有很高的储氢密度,相对便宜的价格以及良好的可逆储氢性能,在储氢材料中具有重要作用和地位,一直都是广大研究者关注的焦点。回答下列问题:
(1)请写出MgH2的电子式:____。
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式:____。
Ⅱ.(3)尿素(H2NCONH2)水解生成H2NCOONH4(氨基甲酸铵,简称甲铵),甲铵不稳定,迅速分解生成两种气态化合物,溶于水后,一个呈酸性,一个呈碱性,请写出甲铵受热分解的化学方程式:____。
(4)甲铵在不同条件下分解的能量变化如图所示,N过程与M过程相比,N过程活化能大大降低的原因可能是____;ΔH=___kJ·mol1。

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:
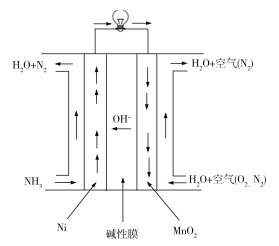
(5)MnO2电极为__极(填“正”“负”“阴”或“阳”),写出Ni电极的电极反应式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺.三聚氰胺的分子式为C3N3(NH2)3下列有关三聚氰胺的说法不正确的是( )
A.三聚氰胺的摩尔质量为126
B.三聚氰胺中C、N、H的原子个数比为1:2:2
C.三聚氰胺中C、N两种元素的质量比为3:7
D.三聚氰胺中氮元素的质量分数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)
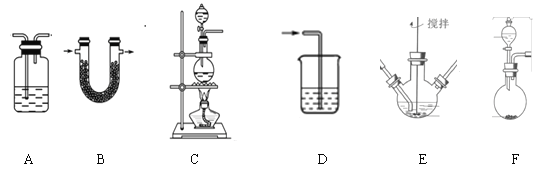
①请写出该过程中制备氯气的离子反应方程式________________(锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_________→ E →_________。(上述装置不一定全部用到,装置可以重复选用)
③装置E中反应时需进行搅拌,目的是_______________________
④E中得到紫色固体和溶液。E中生成高铁酸钾的反应为______________;反应充分进行后,E中溶液中主要的阴离子为__________________
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是( )
A. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚”,体现了合金硬度方面的特征
B. 《天工开物》中有“至于矾现五金色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物
C. 《本草纲目》中记载:“此即地霜也。所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成。”文中对硝酸钾的提取涉及溶解、蒸发、结晶操作
D. 《清嘉录》中记载:“研雄黄末,屑蒲根,和酒饮之,谓之雄黄酒。”其中的雄黄是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地震灾区的水需用杀菌消毒剂处理后才能确保饮水安全。救灾物资中的一瓶“84消毒液”的包装说明上有如下信息:含25%NaClO(次氯酸钠)、1000mL、密度1.19gcm-3,稀释100倍(体积比)后使用。
请回答下列问题:
(1)上述“84消毒液”的物质的量浓度为______molL-1。
(2)该同学取100mL上述“84消毒液”,稀释后用于消毒,稀释100倍后的溶液中c(Na+)=______molL-1(假设稀释后溶液密度为1.0gcm-3),该消毒液长时间放置在空气中能吸收标准状况下CO2的体积为______L。
(3)灾区志愿者根据上述“84消毒液”的包装说明,欲用NaClO固体(NaClO易吸收空气中的H2O、CO2)配制480mL含25%NaClO的消毒液。下列说法正确的是______。
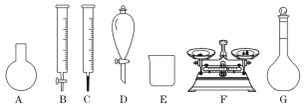
a.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
b.容量瓶用蒸馏水洗净后,要烘干才能用于溶液的配制
c.利用购买的商品NaClO来配制可能会导致结果偏低
d.需要NaClO固体的质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油![]() 转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得
转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得![]() ,反应过程如下:
,反应过程如下:
反应Ⅰ |
| 甘油水蒸气重整 |
反应Ⅱ |
| 甘油部分氧化 |
反应Ⅲ |
| 甘油氧化水蒸气重整 |
下列说法正确的是( )
A. ![]() B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
C. 消耗等量的甘油,反应的产氢率最高D. 甘油不溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(![]() )又名大苏打、海波,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定,广泛应用于日常生产生活中。回答下列问题:
)又名大苏打、海波,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定,广泛应用于日常生产生活中。回答下列问题:
I.硫代硫酸钠的结构与性质
(1)![]() 的结构式如图所示,其中
的结构式如图所示,其中![]() 的化合价为____。
的化合价为____。

(2)![]() 在酸性条件下性质不稳定。取少量
在酸性条件下性质不稳定。取少量![]() 溶液于试管中,滴入少量6
溶液于试管中,滴入少量6![]() 的盐酸,发生反应的离子方程式为____。
的盐酸,发生反应的离子方程式为____。
II.硫代硫酸钠晶体的制备
(3)在圆底烧瓶中加入12g![]() 、60mL水、4g硫黄,加热1小时后,趁热减压过滤;再用乙醇洗涤晶体、干燥后得到
、60mL水、4g硫黄,加热1小时后,趁热减压过滤;再用乙醇洗涤晶体、干燥后得到![]() 晶体。
晶体。
①写出制备![]() 的化学方程式:____。
的化学方程式:____。
②用乙醇洗涤晶体的原因是________。
III.![]() 晶体含量的测定
晶体含量的测定
(4)准确称取1.5g产品,加入20mL煮沸并冷却后的水使其完全溶解,以淀粉作指示剂,用0.1000 ![]() 碘的标准溶液滴定。已知:
碘的标准溶液滴定。已知:![]() (无色)+
(无色)+![]() ,杂质与碘水不反应。
,杂质与碘水不反应。
①碘的标准溶液应盛放在____(填“酸式”或“碱式”)滴定管中。
②判断滴定终点的现象为____。
③第一次滴定开始和结束时,滴定管中的液面如图所示,则第一次消耗碘的标准溶液的体积为____mL。

④重复上述操作两次,记录数据如下表,则产品中的含量为____%(结果保留1位小数)。
滴定次数 | 滴定前读数/mL | 滴定后读数/mL |
第二次 | 1.56 | 30.30 |
第三次 | 0.22 | 26.31 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com