
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:

已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。

【答案】(1)2MnOOH+C ![]() 2MnO+CO↑+H2O↑ 反应过程中产生氯气,造成环境污染 加快酸浸时的反应速率 C、 Fe(OH)3 先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全 3≤pH<5.5 阳 C6H12O6-2e-=C6H10O6+2H+
2MnO+CO↑+H2O↑ 反应过程中产生氯气,造成环境污染 加快酸浸时的反应速率 C、 Fe(OH)3 先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全 3≤pH<5.5 阳 C6H12O6-2e-=C6H10O6+2H+
【解析】
废料中加入过量的炭黑,还原焙烧,锰元素变成二价锰离子,酸浸时得到锰离子、锌离子和亚铁离子,过量的碳黑不溶于酸,过滤变成滤渣1,溶液中需要除去亚铁离子,利用表格数据,应将亚铁离子氧化为铁离子以氢氧化铁沉淀形成分离除去,但是需要注意二价锰离子在酸性条件下比较稳定,pH高于5.5时易被O2氧化,所以应先通入氧气,后加入碳酸锰调节溶液的pH值并控制二价锰离子不被氧化。最后通过电解,锌离子得到电子在阴极生成锌,二价锰离子在阳极失去电子生成二氧化锰。
(1)MnOOH与炭黑反应,锰元素被还原为MnO ,因为碳过量时生成一氧化碳,方程式为:2MnOOH+C ![]() 2MnO+CO↑+H2O↑,二氧化锰和浓盐酸反应生成氯气,造成环境污染。
2MnO+CO↑+H2O↑,二氧化锰和浓盐酸反应生成氯气,造成环境污染。
(2)加热和搅拌都可以加快酸浸时的反应速率,碳不溶于水或酸,所以滤渣1为碳,溶液中通入氧气和加入碳酸锰,使铁元素变成Fe(OH)3沉淀而分离。
(3)实验过程中需要将亚铁离子氧化并沉淀,但不能将锰元素氧化和沉淀,因为二价锰在酸性条件下很稳定,所以先通入氧气,先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全,当铁离子浓度小于或等于10-5mol/L时认为完全沉淀,假设此时溶液中的氢氧根离子浓度为xmol/L,则有10-5×x3=10-38,解x=10-11mol/L,则溶液的pH为3,溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,形成Mn(OH)2沉淀时的氢氧根离子浓度为ymol/L,则有0.1×y2=10-13,形成Zn (OH)2沉淀时的氢氧根离子浓度为zmol/L,0.1×z2=10-17,y=10-6 mol/L,z=10-8 mol/L,对应的pH分别为8和6,且Mn2+在pH高于5.5时易被O2氧化,所以应调节pH范围为3≤pH<5.5。
(4)电解过程中锰元素化合价升高,在阳极生成二氧化锰。
(5)二氧化锰做氧化剂,得到电子,在正极反应,则葡萄糖失去电子,电极反应为:C6H12O6-2e-=C6H10O6+2H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填序号),一定不变的是________(填序号)。一定变大的是________(填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是

A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是_________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+离子中的大π键应表示为________。
),则EMIM+离子中的大π键应表示为________。

(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能达到实验目的的是
A.  分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液
B.  验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应
C.  蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体
D. 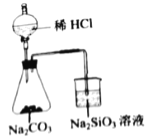 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)与N2O4是火箭发射中最常用的燃料与助燃剂,回答下列问题:
(1)T℃时,将一定量的NO2或N2O4充入一个容积为2L的恒容密闭容器中,发生反应2NO2(g)![]() N2O4(g),保持温度不变,各物质的浓度随时间变化关系如下表:
N2O4(g),保持温度不变,各物质的浓度随时间变化关系如下表:

①c(Y)代表___________(填化学式)的浓度,20~40s内,用NO2表示的化学反应速率为___________。
②该反应的平衡常数K=___________。
③60s时容器内混合气体的密度为_____g·L-1。
④100s时改变的条件是___________,重新达到平衡时,与原平衡比较,NO2的体积分数将___________(填“增大”“减小”或“不变”)。
(2)①已知2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) △H=-QkJ·mol-1,相关化学键的键能如表所示。
3N2(g)+4H2O(g) △H=-QkJ·mol-1,相关化学键的键能如表所示。

使 1molN2O4(g)完全分解成相应的原子时需要吸收的能量是___________kJ(用代数式表示)

②相同温度下,向Ⅰ、Ⅱ、Ⅲ三个恒压密闭容器中均充入1molN2H4(g)和1molN2O4(g),三个容器的反应压强分别为p1、p2、p3。在其它条件相同的情况下,反应进行到tmin时,N2的体积分数如图所示,此时容器I___________(填“处于”或“不处于”)化学平衡状态,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol/LNaOH溶液以备使用。
(1)该同学应用托盘天平称取NaOH固体_____g。
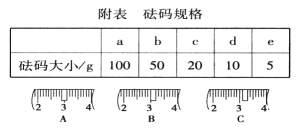
(2)用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小(填字母)__________,并在下图中选出能正确表示游码位置的选项(填字母) ____________。
(3)配制时,正确的操作顺序是________
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管滴加蒸馏水,使溶液凹液面恰好与刻度线相切
F.往容量瓶内加蒸馏水,直到溶液在刻度线下1~2cm处
(4)若出现以下情况,对所配溶液浓度将有何影响?(填"偏高""偏低"或"无影响")
①没有进行A操作__________
②转移溶液时不慎将少量的溶液洒在容量瓶外__________
③定容时俯视刻度线___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是( )

A. V(NaOH)=10 mL时,溶液中存在c(Na+)=2c(H2T)+2c(HT-)+2c(T2-)
B. V(NaOH)=20mL时,溶液中存在c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-)
C. V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D. V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com