

分析 (1)根据盖斯定律,①+②×2=③,据此计算反应热,根据平衡常数的定义,两反应相加得的平衡常数相乘,计量数扩大2倍,则平衡常数为原来的平方,据此答题;
(2)①反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,为气体体积不变的放热反应,根据影响平衡移动的因素答题;
②CO(g)+H2O(g)?CO2(g)+H2(g),是一反应前后气体体积不变的反应,当把2L容器中t0时c(CO)=2.0mol/L,在t0时刻将容器的体积扩大至4L,此时c(CO)=1.0mol/L,平衡不移动,各浓度未原平衡时的$\frac{1}{2}$;
(3)根据图象可知,a点未达平衡,随着时间的推移,CO2的转化率增大,即反应正向移动;根据转化率=$\frac{已转化的物质的量}{起始的物质的量}$×100%计算NH3的平衡转化率;
(4)(NH4)2SO4溶液中铵根离子水解生成氢离子,溶液呈酸性,在溶液中存在平衡NH3•H2O?NH4++OH-,根据Kb=$\frac{c(N{H}_{4}{\;}^{+})•c(O{H}^{-})}{c(NH{\;}_{3}•H{\;}_{2}O)}$,溶液中铵根离子与氢氧根离子近似相等,可得c(OH-)=$\sqrt{K{\;}_{b}•c(NH{\;}_{3}•H{\;}_{2}O)}$,据此计算.
解答 解:(1)根据盖斯定律,①+②×2=③,所以△H3=△H1+2×△H2=-1266.8kJ•mol-1+2×180.5kJ•mol-1=-905.8kJ•mol-1,根据平衡常数的定义,两反应相加得的平衡常数相乘,计量数扩大2倍,则平衡常数为原来的平方,所以K3=K1 •K22,
故答案为:-905.8kJ•mol-1;K1 •K22;
(2)①反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,为气体体积不变的放热反应,反应达到平衡后,欲提高CO 的转化率,可降低温度或增加水蒸气的浓度、降低二氧化碳或氢气的浓度等,
故答案为:可降低温度或增加水蒸气的浓度、降低二氧化碳或氢气的浓度等;
②CO(g)+H2O(g)?CO2(g)+H2(g),是一反应前后气体体积不变的反应,当把2L容器中t0时c(CO)=2.0mol/L,在t0时刻将容器的体积扩大至4L,此时c(CO)=1.0mol/L,平衡不移动,各浓度未原平衡时的$\frac{1}{2}$,c(CO)与反应时间t变化曲线为: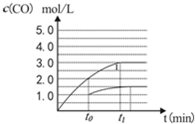 ,
,
故答案为: ;
;
(3)由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为$\frac{1.2a}{4a}$×100%=30%,
故答案为:<;30%;
(4)(NH4)2SO4溶液中铵根离子水解生成氢离子,溶液呈酸性,在溶液中存在平衡NH4++H2O?NH3•H2O+H+,所以(NH4)2SO4溶液中各离子浓度由大到小的顺序是c(NH4+)>c(SO4 2-)>c(H+)>c(OH-),根据Kb=$\frac{c(N{H}_{4}{\;}^{+})•c(O{H}^{-})}{c(NH{\;}_{3}•H{\;}_{2}O)}$,溶液中铵根离子与氢氧根离子近似相等,可得c(OH-)=$\sqrt{K{\;}_{b}•c(NH{\;}_{3}•H{\;}_{2}O)}$=$\sqrt{0.1×2.0×1{0}^{-5}}$mol•L-1=1.414×10-3 mol•L-1,所以pH=-lg$\frac{1{0}^{-14}}{1.414×1{0}^{-3}}$=11+lg1.414=11.15,
故答案为:c(NH4+)>c(SO4 2-)>c(H+)>c(OH-);11.15.
点评 本题较为综合,从多个角度考查外界条件对化学平衡的影响、化学平衡图象、化学平衡计算等,侧重考查化学平衡移动在化学工艺中的应用以及化学平衡计算,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
. (并标出电子转移的方向与数目).
(并标出电子转移的方向与数目). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对溶液所在体系加热,溶液蓝色加深 | |
| B. | 对溶液所在体系用冰水降温,上述反应的平衡常数减小 | |
| C. | 室温下,加水稀释至一定范围,溶液为蓝色 | |
| D. | 室温下,加水稀释至一定范围,溶液为粉红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.03mol | C. | 0.04mol | D. | 0.01~0.03mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

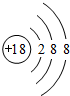 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,若加入KNO3固体,铜粉溶解 | |
| B. | FeCl3、Na2O2、CuS均可由相应单质直接化合生成 | |
| C. | 某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐 | |
| D. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com