
分析 (1)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价由+7价降低为+2价,Cl元素化合价由-1价升高为0价,转移电子数数目为10;
(2)根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,再根据方程式计算消耗高锰酸钾物质的量,根据m=nM计算高锰酸钾的质量;
(3)被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl物质的量.
解答 解:(1)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价由+7价降低为+2价,Cl元素化合价由-1价升高为0价,转移电子数数目为10,标出该反应的电子转移的方向和数目为: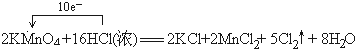 ,
,
故答案为: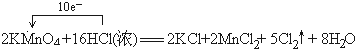 ;
;
(2)氯气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,根据2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O可知,消耗高锰酸钾物质的量为0.05mol×$\frac{2}{5}$=0.02mol,故消耗高锰酸钾的质量为0.02mol×158g/mol=3.16g,
答:消耗高锰酸钾的质量为3.16g;
(3)被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl物质的量为0.05mol×2=0.1mol,
答:被氧化HCl物质的量为0.1mol.
点评 本题考查氧化还原反应电子转移与计算,难度不大,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液呈酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ | |
| B. | 向NH4HCO3溶液中加过量石灰水并加热:${NH}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Fe(OH)2溶于氨碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 氧化亚铜和稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | |
| B. | 胶体能产生丁达尔现象 | |
| C. | 胶体是纯净物,其它分散系是混合物 | |
| D. | 胶体的分散质粒子直径在10-7~10-9m之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2 g O2 和O3 的混合物中含有的氧原子数目为0.2 NA | |
| B. | 101 kPa 0℃时,22.4 L氢气中含有NA个氢原子 | |
| C. | 标准状况下,2.24 L 四氯化碳含有的碳原子数目为0.1NA | |
| D. | 常温常压下,22.4 L 的C2H2气体和C2H4气体的混合物中含有的碳原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子组成的CO2的摩尔质量可表示为(a+2b)NA | |
| B. | 由该原子组成的CO2为ng时,它所含氧原子个数为$\frac{2n}{a+2b}$ | |
| C. | 由该原子组成的CO2为ng时,它所占的体积为$\frac{22.4n}{a+2b}$L | |
| D. | 碳、氧两原子的摩尔质量之比为b:a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com