
| A. | 由乙烯生成乙醇属于加成反应 | B. | 2-甲基丁烷也称异丁烷 | ||
| C. | 油脂和蛋白质都属于高分子化合物 | D. | C4H9Cl有3种同分异构体 |
分析 A.乙烯与水发生加成反应生成乙醇;
B.2-甲基丁烷为含5个C的烷烃;
C.油脂的相对分子质量在10000以下;
D.丁烷、异丁烷中含H种类分别为2、2.
解答 解:A.乙烯中含碳碳双键,可与水发生加成反应生成乙醇,故A正确;
B.2-甲基丁烷为含5个C的烷烃,则也称为异戊烷,故B错误;
C.油脂的相对分子质量在10000以下,不是高分子,而蛋白质属于高分子化合物,故C错误;
D.丁烷、异丁烷中含H种类分别为2、2,则C4H9Cl有4种同分异构体,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的组成、结构对称性等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取8.75 g食盐 | |
| B. | 用25 mL量筒量取12.36 mL盐酸 | |
| C. | 用广泛pH试纸测得某溶液pH值为3.5 | |
| D. | 用碱式滴定管移取NaOH溶液23.10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
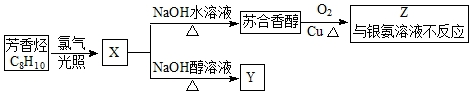
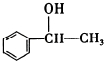 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
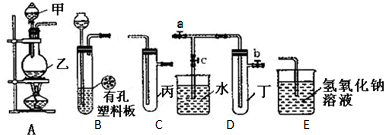
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
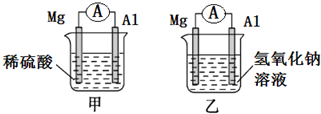 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有共价键的数目为0.4 NA | |
| B. | 常温下,9.2 g NO2和N2O4的混合气体中含有氮原子的数目为0.2 NA | |
| C. | 电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2 NA | |
| D. | 0.1mol苯乙烯中含有碳碳双键的数目为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中一定只含离子键 | |
| C. | W的氢化物与其最高正价氧化物对应水化物可以相互反应生成盐 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com