
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
|
温 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式_________________________________________。
②由上表数据可知该反应为放热反应,理由是_____________________________________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)
+ H2O (g)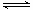 CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)
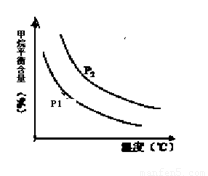
+ 3H2(g) 获取,已知该反应中,当初始混合气中的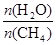 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
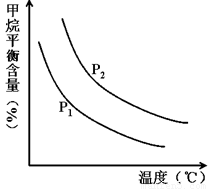
①图中,两条曲线表示压强的关系是:P1________P2(填“>”、“=”或“<”)。
②该反应为_____________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) +
H2O(g)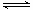 CO2
(g) + H2(g) 获取。
CO2
(g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
(1)①N2 + 3H2 2 NH3(2分) ② 随温度升高,反应的平衡常数K减小(2分)
2 NH3(2分) ② 随温度升高,反应的平衡常数K减小(2分)
③a、d(2分) (2)①<(2分)②吸热(2分)
(3)①60 %(2分) 9/4或2.25(2分) ②c和d(2分)
【解析】
试题分析:(1)①工业上利用氮气和氢气在一定条件下发生化合反应制备氨气,所以工业合成氨的化学方程式为N2 + 3H2 2 NH3。
2 NH3。
②根据表中数据可知,随着温度的逐渐升高,平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。
③合成氨是体积减小的放热的可逆反应,则a、增大压强,平衡向正反应方向移动,氢气的转化率增大,a正确;b、催化剂只能改变反应速率,而不能改变平衡状态,所以使用合适的催化剂不能改变氢气的转化率,b不正确;c、升高温度,平衡向逆反应方向移动,氢气的转化率降低,c不正确;d、及时分离出产物中的NH3,降低生成物浓度,平衡向正反应方向移动,氢气转化率增大,d正确,答案选ad。
(2)①根据方程式可知正方应是体积增大的可逆反应,因此增大压强平衡向逆反应方向移动,甲烷的平衡含量增大。根据图像可知,在温度相同时P2曲线对应的甲烷含量高,所以压强关系是P1<P2。
②根据图像可知,在压强恒定时,随之温度的升高,甲烷的含量降低。这说明升高温度平衡向正反应方向移动,即正方应是吸热反应。
(3)①
CO(g) + H2O(g)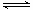 CO2
(g) + H2(g)
CO2
(g) + H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.08 0.12 0.12
所以根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下平衡常数K=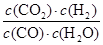 =
=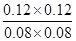 =
=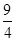 。
。
平衡时CO的转化率=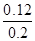 ×100%=60%。
×100%=60%。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、该反应是体积不变的可逆反应,因此反应前后压强始终是不变,所以容器内压强不随时间改变不能说明反应达到平衡状态,a不正确;b、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即密度始终是不变的,所以混合气体的密度不随时间改变不能说明反应达到平衡状态,b不正确;c、单位时间内生成a mol CO2的同时必然同时生成amol氢气,又因为消耗a mol H2,这说明正逆反应速率相等,反应达到平衡状态,c正确;d、混合气中n(CO) : n(H2O) : n(CO2)
: n(H2) = 1: 16 : 6 : 6,此时Q=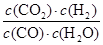 =
=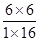 =
=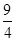 ,所以反应达到平衡状态,d正确,答案选cd。
,所以反应达到平衡状态,d正确,答案选cd。
考点:考查外界条件对平衡状态的影响、平衡状态判断、平衡常数以及转化率的有关计算


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2013-2014学年山东省新泰市高三上学期阶段化学试卷(解析版) 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
|
温 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①由上表数据可知该反应为放热反应,理由是 。
② 理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)
+ H2O (g) CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的 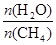 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) +
H2O(g) CO2
(g) + H2(g) 获取。
CO2
(g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
查看答案和解析>>
科目:高中化学 来源:2014届北京市海淀区高三上学期期中考试化学试卷(解析版) 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
|
温 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式 。
②由上表数据可知该反应为放热反应,理由是 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O
(g)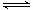 CO(g)+3H2(g)
获取,已知该反应中,当初始混合气
CO(g)+3H2(g)
获取,已知该反应中,当初始混合气
中的 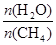 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
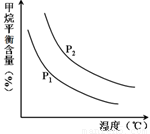
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)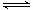 CO2
(g)+H2(g) 获取。
CO2
(g)+H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度
为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说
明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
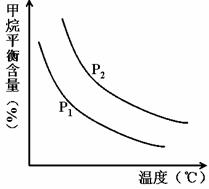 (2)原料气H2可通过反应 CH4(g) + H2O (g)
(2)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为,该温度下反应的平衡常数K值为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式。
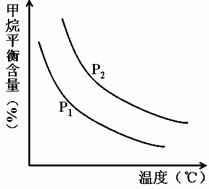 ②由上表数据可知该反应为放热反应,理由是。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为,该温度下反应的平衡常数K值为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com