
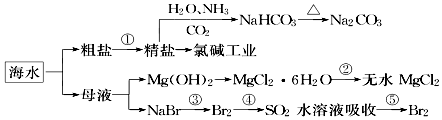
 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
分析 海水晒盐得到粗盐和母液,粗盐精制得到精盐,制成氯化钠饱和溶液,通入氨气、二氧化碳反应生成碳酸氢钠晶体,过滤得到碳酸氢钠,碳酸氢钠受热分解得到碳酸钠,电解饱和食盐水生成氯气、氢气和氢氧化钠,母液加入石灰乳沉淀镁离子生成氢氧化镁沉淀,过滤后沉淀溶解得到氯化镁溶液,蒸发浓缩析出氯化镁晶体,在氯化氢气流中失去结晶水得到固体氯化镁,溴化钠溶液中通入氯气氧化溴离子为溴单质,溴单质被二氧化硫溶液吸收,再通入氯气得到溴单质,富集溴,
A.根据物质的性质以及变化结合元素化合价的变化判断;
B.NaHCO3和Na2CO3都与澄清石灰水反应生成沉淀;
C.碳酸氢钠在反应涉及物质中溶解度最小,易与分离而促进反应向生成物方向进行,制取NaHCO3的反应是利用其溶解度小于NaCl;
D.电解饱和MgCl2溶液不能得到镁.
解答 解:A.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,④中溴得电子化合价降低,所以溴元素被还原,故A错误;
B.NaHCO3和Na2CO3都与澄清石灰水反应生成沉淀,不能鉴别,应用氯化钙溶液鉴别,故B错误;
C.碳酸氢钠在反应涉及物质中溶解度最小,向饱和食盐水中通入氨气以及二氧化碳,溶解度较小的碳酸氢钠会先析出,制取NaHCO3的反应是利用其溶解度小于NaCl,故C正确;
D.镁为活泼金属,电解氯化镁溶液,在阳极生成氯气,在阴极生成氢气和氢氧化镁沉淀,不能得到镁,应用电解熔融氯化镁的方法冶炼,故D错误.
故选C.
点评 本题考查海水资源的综合应用,为高频考点,把握金属冶炼、氧化还原反应及海水提碘、海水提溴的反应原理为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
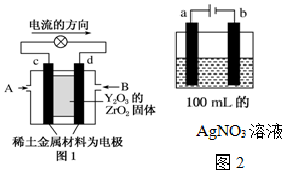 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
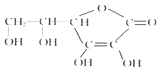 维生素C的结构简式如图所示:
维生素C的结构简式如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
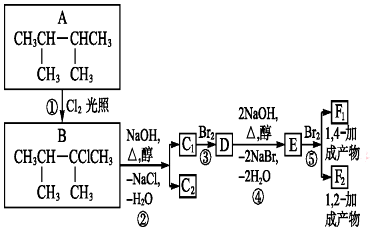
 .
. ;F1的结构简式是
;F1的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | 1摩尔任何物质所含的分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com