
【题目】某氨气燃料电池,如图所示,下列说法不正确的是

A.正极的电极反应式为O2+4e-+4H+=2H2O
B.电子流向:电极1→负载→电极2
C.Na+由左向右移动
D.NH3在电极1上发生氧化反应
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
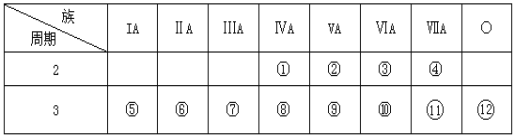
(1)写出③、⑤两种元素形成的化合物有两种,电子式分别是:__,___。
(2)写出①元素形成最简单有机物是__,它和氯气反应的一个方程式__。
(3)这些元素的最高价氧化物的对应水化物中__酸性最强;__碱性最强;能形成两性氢氧化物的元素是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、 (y)、
(y)、![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. y的二氯代物有3种 B. x、y和z均能与溴水发生反应
C. z中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是_____;
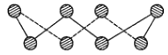
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的电负性由大到小的顺序为___;
(3)Se原子序数为____,其核外M层电子的排布式为____;
(4)H2Se的酸性比H2S___(填“强”或“弱”)。气态SeO3分子的立体构型为____,SO32-离子的立体构型为______;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____pm(列式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度有利于该反应平衡正向移动
B. 达到化学平衡时,v正(A2)=2v逆(B2)
C. 升高温度,正向反应速率增加,逆向反应速率减小
D. 达到平衡后,降低温度A2气体的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示。下列说法中不正确的是( )
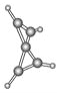
A. 该分子的分子式为C5H4
B. 该分子中碳原子的化学环境有2种
C. 该分子中的氢原子分布在两个相互垂直的平面上
D. 该分子中只有C—C键,没有![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知某溶液中存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol—OH(羟基)与l mol![]() 中所含电子数均为10NA
中所含电子数均为10NA
B.常温常压下,水蒸气通过过量的Na2O2使其增重2 g时,反应中转移的电子数为NA
C.0.lmol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA
D.10g KHCO3和CaCO3的固体混合物中含有的![]() 数目为0.1NA
数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com