
| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.可用sp2杂化轨道来解释说明中心原子含有3个价层电子对,据此分析判断.
解答 解:①BF3分子中价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,中心原子杂化类型分别为sp2,故①正确;
②CH2═CH2 分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,每个碳原子杂化轨道数为3,所以采取sp2杂化,故②正确;
③苯分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,杂化轨道数为3,所以采取sp2杂化,故③正确;
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,碳原子价层电子对个数=2+$\frac{1}{2}$(4-4×1)=2,每个碳原子杂化轨道数为2,所以采取sp杂化,故④错误;
⑥CH4中碳原子价层电子对个数=4+0=4,为sp3杂化,故⑥错误;
故选A.
点评 本题考查了原子杂化类型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.6 g O2和O3混合气体中原子总数为0.1NA | |
| B. | 标准状况下,过氧化钠与水反应生成1.12 L氧气时转移电子数目为0.2NA | |
| C. | 0.1 mol•L的CH3COONa溶液中CH3COOH和CH3COO-总数为0.1NA | |
| D. | 常温常压下,4 g He中,含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+2HCl═CuCl2+H2O | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | Zn+H2SO4═ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先生成沉淀,后沉淀全部溶解 | |
| B. | 当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大 | |
| C. | 最后得到的沉淀是BaSO4 | |
| D. | 最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(OH-) | B. | c(HCN)+c(CN-)=0.2 mol•L-1 | ||
| C. | c(Na+)=c(CN-)+c(OH-) | D. | c(Na+)=c(CN-)+c(HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
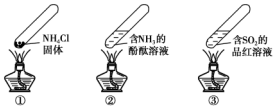 “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )| A. | 加热时,①中上部汇集了NH4Cl固体 | |
| B. | 加热时,②中溶液变红,冷却后又都变为无色 | |
| C. | 加热时,③中溶液变红,冷却后红色褪去,体现SO2的漂白性 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据结构相似的分子的熔点与相对分子质量的关系,推出PH3比NH3熔点高 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
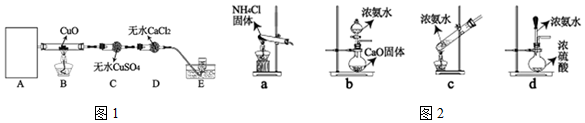
| 序号 | 现象 | 结论 |
| I | B装置中黑色氧化铜变为红色 | 反应生成了Cu或Cu2O |
| II | C装置中无水CuSO4变蓝 | 反应生成了H2O |
| III | E装置中收集到无色无味气体 | 反应生成了N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,v(NO)≠v(N2) | |
| D. | 升高温度正逆反应速率均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com