
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为___,G的原子结构示意图是___。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为___,所含化学键类型为___。向甲中滴加足量水时发生反应的化学方程式是___。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是___。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的___极,负极的电极反应式为___。
【答案】第二周期第ⅤA族 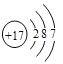
![]() 离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O=4NaOH+O2↑ r(S2-)>r(Cl-)>r(Na+) 负 CH4+10OH--8e-=CO
离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O=4NaOH+O2↑ r(S2-)>r(Cl-)>r(Na+) 负 CH4+10OH--8e-=CO![]() +7H2O
+7H2O
【解析】
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素。
(1)C是氮元素,原子有2个电子层,最外层电子数为5,在元素周期表中的位置:第二周期第VA族,G为Cl元素,原子结构示意图是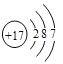 ,故答案为:第二周期第VA族;
,故答案为:第二周期第VA族;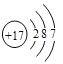 ;
;
(2)D与E按原子个数比1:1形成化合物甲为Na2O2,其电子式为![]() ,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:![]() ;离子键、共价键;2Na2O2+2H2O═4NaOH+O2↑;
;离子键、共价键;2Na2O2+2H2O═4NaOH+O2↑;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+,故答案为:S2->Cl->Na+;
(4)用CH4、O2和NaOH的水溶液组成燃料电池,电极材料为多孔惰性金属电极.在a极通入CH4气体,b极通入O2气体,甲烷发生氧化反应,则a极是该电池的负极,b为正极,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极的电极反应式为:O2+2H2O+4e-=4OH-,而负极甲烷失电子,在碱性环境下生成碳酸根离子,极反应方程式:CH4+10OH--8e-=CO![]() +7H2O;
+7H2O;
故答案为:负;CH4+10OH--8e-=CO![]() +7H2O;
+7H2O;


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
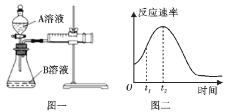
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO![]() +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
(1)该实验探究的是___因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO![]() )=___mol·L-1(假设混合液体积为50mL)。
)=___mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①产物MnSO4是该反应的催化剂、②___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:

已知:
①I2(s)+I-(aq)![]() I3-(aq)。
I3-(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为___。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是___。
(2)步骤Ⅱ,水合肼与IO反应的离子方程式为___。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为___。
(5)将制备的NaI2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序___。
加热乙醇→ → → → →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O;(B)2FeCl3+Cu=2FeCl2+CuCl2,根据两反应本质,判断能设计成原电池的反应是___(填字母)。
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池。写出电池的正极电极反应式___。
(3)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内部的新型发电装置,是一种具有应用前景的绿色电源。如图为氢氧燃料电池原理示意图,按照此图的提示回答下列问题:
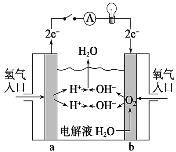
①该燃料电池的负极是___(填“a”或“b”)。
②___(填化学式)发生还原反应。
③总反应式是___。
(4)锌锰干电池是最早使用的化学电池,其基本构造如图所示:锌锰干电池的负极是锌(Zn),电路中每通过0.4mole-,负极质量减少___g;工作时NH![]() 在正极放电产生两种气体,其中一种气体分子是10e-的微粒,正极的电极反应式是___。
在正极放电产生两种气体,其中一种气体分子是10e-的微粒,正极的电极反应式是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:
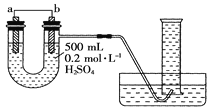
(1)b电极反应式为___。
(2)当量筒中收集到672mL(标准状况下)气体时,通过导线的电子的物质的量为__,此时a电极质量减少____g。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。
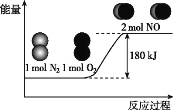
已知:断开1molN2(g)中化学键需吸收946kJ能量,断开1molO2(g)中化学键需吸收498kJ能量。下列说法正确的是( )
A.N2和O2的总能量一定高于NO的总能量
B.2NO(g)=N2(g)+O2(g),该反应为吸热反应
C.断开1molNO(g)中化学键需吸收90kJ能量
D.形成1molNO(g)中化学键可释放632kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A(?)+2B(g) ![]() nC(g)在一定条件下达到平衡后,改变下列条件。请回答
nC(g)在一定条件下达到平衡后,改变下列条件。请回答
(1)增压,平衡不移动,当n=3时,A的状态为______________;
(2)若A为固态,增大压强,C的百分含量增加,则n=________;
(3)升温,平衡向右移动,则该反应的正反应为______________反应(填放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___;反应进行一段时间后溶液酸性将__(填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___,B(负极)极材料为__,溶液C为___。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
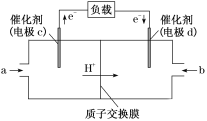
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__(填“正极”或“负极”),c电极的反应方程式为__。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
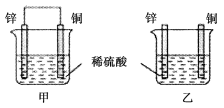
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO42-向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲乙两烧杯中Cu片的质量均不变
A. ①②③B. ③⑤⑦
C. ④⑤⑥D. ②③④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com