
分析 根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的物质的量浓度,再根据配制过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积.
解答 解:分数为98%、密度为1.84g•cm-3的浓硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
配制过程中硫酸的物质的量不变,则需要该浓硫酸的体积为:$\frac{1mol/L×0.5L}{18.4mol/L}$≈0.0272L=27.2mL,
故答案为:27.2.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握稀释定律在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(NH2-) | B. | c(NH4+)=1×10-29 mol•L-1 | ||
| C. | c(NH2-)>c(NH4+) | D. | c(NH4+).c(NH2-)=1.0×10-30 mol2•L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
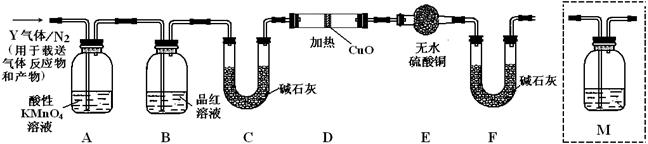 (3)装置B中试剂的作用是检验SO2是否除尽.
(3)装置B中试剂的作用是检验SO2是否除尽.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
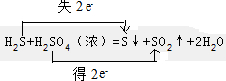 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com