
(8分)某含FeS2的硫铁矿样品10 g在过量的氧气中充分燃烧后,残余固体质量为8 g。用此种硫铁矿在工业上生产硫酸,若生产过程中有2%的硫损失,欲制得490 t 98%的浓硫酸,此硫铁矿的纯度为多少?理论上需要这种硫铁矿多少吨?
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
![]()
(1)若X具有强氧化性,举两例分别写出对应的A、B、C的化学式(FeS2不能填写)。
例1:A________________,B________________,C________________。 例2:A_____________, B______________,C______________。
(2)若X为较活泼的金属,向C的水溶液中滴加硝酸银溶液有不溶于稀硝酸的白色沉淀析出,则B可能的化学式是_______________。若将铜片和碳棒用导线连接后插入B的水溶液中,构成原电池,写出负极的电极反应式:__________________________________________。
(3)若上述(2)中C溶液保存时需加入少量X,理由是____________________________。
(4)若A是一种常见的无机化合物,请写出反应①的化学方程式:(只要求写一例)
____________________________________________________________________。
(5)某工厂用含FeS260%的硫铁矿通过上述途径制取硫酸。已知反应①中S的损失率为2%,反应②中S的转化率为90%,则100 t硫铁矿可生产98%的浓硫酸__________吨。
查看答案和解析>>
科目:高中化学 来源:2010年上海市浦东新区高考预测化学卷 题型:计算题
工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2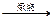 2Fe2O3+8SO2 ①
2Fe2O3+8SO2 ①
FeS2+2HCl→ FeCl2+H2S↑+S↓ ②
2H2S+SO2→ 3S+2H2O ③
2NaOH+SO2→Na2SO3+H2O ④
Na2SO3+S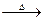 Na2S2O3 ⑤
Na2S2O3 ⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?
查看答案和解析>>
科目:高中化学 来源:2010年上海市浦东新区高考预测 题型:计算题
工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2 2Fe2O3+8SO2 ①
2Fe2O3+8SO2 ①
FeS2+2HCl→ FeCl2+H2S↑+S↓ ②
2H2S+SO2→ 3S+2H2O ③
2NaOH+SO2→Na2SO3 +H2O ④
Na2SO3+S Na2S2O3 ⑤
Na2S2O3 ⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2![]() 2Fe2O3+8SO2 ①
2Fe2O3+8SO2 ①
FeS2+2HCl→ FeCl2+H2S↑+S↓ ②
2H2S+SO2→ 3S+2H2O ③
2NaOH+SO2→Na2SO3 +H2O ④
Na2SO3+S![]() Na2S2O3 ⑤
Na2S2O3 ⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com