
| A、银氨溶液中加入足量盐酸产生沉淀[Ag(NH3)2]-+OH-+3H++Cl-═AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
| C、孔雀石可溶于盐酸 CO32-+2H+═CO2↑+H2O |
| D、氧化铁可溶于氢碘酸 Fe2O3+6H+═2Fe3++3H2O |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H3O++CO32- |
| B、CH3COO-+H2O?CH3COOH+OH- |
| C、CO32-+H2O?HCO3-+OH- |
| D、Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
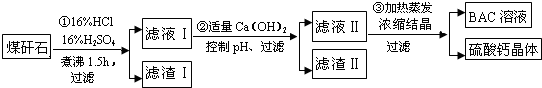
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滑石粉属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO?4SiO2?H2O |
| B、次氯酸钠、石灰、明矾可作消毒杀菌剂;碳酸钡俗称“钡餐”,是一种医疗药品 |
| C、水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体 |
| D、毛、发等的主要成分都是蛋白质,蛋白质水解的最终产物是氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱金属中密度最小、熔沸点最高的是锂 |
| B、自上而下所形成的阳离子的氧化性依次减弱 |
| C、它们都能与水反应生成把氢气和碱 |
| D、它们都能在空气中燃烧生成M2O(M指碱金属) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:8 |
| C、2:3 | D、8:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com