
| A、原子半径大小:Z>Y>X>W |
| B、Y、Z两种元素的氧化物对应的水化物酸性为:Y<Z |
| C、X、Y、Z三种元素的单质均既有氧化性又有还原性 |
| D、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、等物质的量的弱酸HA与其钾盐KA的混合溶液中:2c(K+)=c(HA)+c(A-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、氨水中逐滴加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=3的一元酸HA溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(A-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
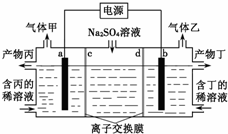 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)| A、a电极反应式为:2H++2e-═H2↑ |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阴离子交换膜 |
| D、每转移0.1 mol电子,产生1.12 L的气体乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
| B、SO2、SO3都是极性分子 |
| C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
| D、金属具有的光泽是金属吸收光子而发生跃迁发出特定波长的光波 |
查看答案和解析>>
科目:高中化学 来源: 题型:
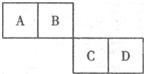 已知A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,它们的原子序数之和为46.请填空:
已知A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,它们的原子序数之和为46.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com