

| 134×35.8% |
| 12 |
| 134×4.48% |
| 1 |
| 134-12×4-6 |
| 16 |
 .
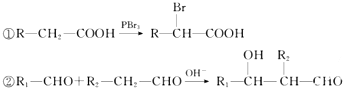
. ,H酸化得到I为
,H酸化得到I为 ,I发生氧化反应得到J为
,I发生氧化反应得到J为 ,J与氢气发生加成反应得到苹果酸,据此解答.
,J与氢气发生加成反应得到苹果酸,据此解答.| 134×35.8% |
| 12 |
| 134×4.48% |
| 1 |
| 134-12×4-6 |
| 16 |
 .
. ,H酸化得到I为
,H酸化得到I为 ,I发生氧化反应得到J为
,I发生氧化反应得到J为 ,J与氢气发生加成反应得到苹果酸,
,J与氢气发生加成反应得到苹果酸,| 水 |
| △ |
| 水 |
| △ |
 +2NaHCO3→
+2NaHCO3→ +2CO2↑+2H2O,
+2CO2↑+2H2O, +2NaHCO3→
+2NaHCO3→ +2CO2↑+2H2O;
+2CO2↑+2H2O; 、
、 ,故答案为:
,故答案为: 、
、 .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、X>Y>Z |
| B、Z>Y>X |
| C、Y>X>Z |
| D、X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沙尘暴中含有CaCO3,可以中和酸雨 |
| B、酸雨是指酸性降水或雨水的pH<7 |
| C、未受污染的清洁空气中降下的雨水一定是中性雨水? |
| D、夏季空气中温度较高,所以SO2和NO被转化为硫酸和硝酸更加容易,故夏季雨水酸性会更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| A、Mg(OH)2和Al(OH)3高温下不分解,所以可做工业阻燃剂 |
| B、等质量Mg(OH)2和Al(OH)3相比,Mg(OH)2阻燃效果较好 |
| C、Mg(OH)2比Al(OH)3热稳定性高 |
| D、Mg(OH)2和Al(OH)3作为工业阻燃剂与它们分解吸热及生成物具有耐高温性有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原CH3COOH溶液中c(H+)与NaOH溶液中c(OH-)相等 |
| B、此过程溶液中水的电离程度先增大后减小,溶液的pH增大 |
| C、加至VmL时,溶液呈中性 |
| D、加至2VmL时,溶液中c(CH3COO-)+c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com