
| A. | 75% | B. | 50% | C. | 5% | D. | 12.5% |
分析 混合烃燃烧的方程式有:C4H8+6O2=4CO2+4H2O、C2H4+3O2=2CO2+2H2O、C3H8+5O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C4H8和C3H8一共为xmL,C2H2为ymL,列方程计算,进而计算原混合烃中C2H4的体积分数.
解答 解:除去水蒸气,恢复到原来的温度和压强,水为液态,则:
C4H8+6O2=4CO2+4H2O~△V=3
1 6 4 3
C2H4+3O2=2CO2+2H2O~△V=2
1 3 2 2
C3H8+5O2=3CO2+3H2O~△V=3
1 5 3 3
相同体积的C4H8和C3H8反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C4H8和C3H8一共为xmL、C2H4为ymL,
则有:x+y=20、3x+2y=50,
解得:x=10、y=10,所以原混合烃中C2H4的体积分数为$\frac{10}{20}$×100%=50%,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,解答关键是根据方程式判断体积变化,把C2H6和C3H6看作一个组分,从而将3种物质转化为两组分混合,注意掌握差量法在化学计算中的应用方法.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol•L-1亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5molCH5+中含有的电子数目为5NA | |
| D. | 常温下,1L0.5mol•L-1Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦ | B. | ①⑤⑥ | C. | ②③⑤ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO中少量O2:通过灼热的Cu网后收集气体 | |
| B. | 除去K2CO3中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去N2中少量NH3,可依次通过水、浓H2SO4洗后收集气体 | |
| D. | 可用铁粉除去FeCl3溶液中的少量的CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
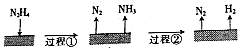
| A. | 肼属于共价化合物 | |
| B. | 图示过程①、②都是吸热反应 | |
| C. | 反应Ⅰ中氧化剂与还原剂的物质的量之比为2:1 | |
| D. | 200℃时,肼分解的热化学方程式为:N2H4(g)═N2(g)+2H2(g)△H═+50.7kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该稀硝酸中HNO3的物质的量浓度是4.0mol/L | |
| B. | 加入NaOH溶液的体积是560mL | |
| C. | 被还原的硝酸的物质的量为0.04mol | |
| D. | 得到的金属氢氧化物的沉淀为5.81克 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离了 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
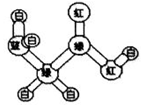 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com