
 ;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程
;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程 .
. 分析 (1)铁是26号元素,位于周期表第四周期,第Ⅷ族;
(2)金属性最强,与水反应越剧烈;非金属性越强,单质与水反应越剧烈;同周期自左而右原子半径减小,电子层越多原子半径越大;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;最高价氧化物对应水化物的酸性最强是高氯酸;所形成的氢化物中沸点最高的是水;
(3)A元素原子M电子层上有7个电子,说明其K层和L层已经排满,则A为氯元素;B元素与A元素位于同一周期,则B元素位于第三周期,B元素的原子最外电子层只有1个电子,则B为Na元素,据此进行解答.
解答 解:(1)铁是26号元素,位于周期表第四周期,第Ⅷ族,故答案为:Ⅷ;
(2)同周期自左而右金属性减弱,同主族自上而下金属性增强,稀有气体化学性质稳定,故1-18元素中金属性最强为Na,与水反应最剧烈;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,稀有气体化学性质稳定,故1-18元素中非金属性最强为F,氟气与水反应最剧烈;同周期自左而右原子半径减小,同主族自上而下原子半径增大,其电子层越多原子半径越大,故原子半径最小是H;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故F元素非金属性最强,非金属性越强,氢化物越稳定,故HF最稳定;最高价氧化物对应水化物的酸性最强是高氯酸,化学式为HClO4;所形成的氢化物中沸点最高的是水,
故答案为:Na;F2;H;HF;HClO4;水;
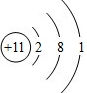
(3)A元素原子M电子层上有7个电子,说明其K层和L层已经排满,则A为氯元素;B元素与A元素位于同一周期,则B元素位于第三周期,B元素的原子最外电子层只有1个电子,则B为Na元素,钠原子的核电荷数为11,最外层电子式为1,其原子结构示意图为: ,A为氯元素最外层7个电子,为-1价、B为钠元素最外层一个电子为+1价,钠和氯形成的化合物为氯化钠,钠离子和氯离子通过离子键结合属于离子化合物NaCl,用电子式表示氯化钠的形成过程为:
,A为氯元素最外层7个电子,为-1价、B为钠元素最外层一个电子为+1价,钠和氯形成的化合物为氯化钠,钠离子和氯离子通过离子键结合属于离子化合物NaCl,用电子式表示氯化钠的形成过程为: ,
,
故答案为: ;氯化钠;
;氯化钠; .
.
点评 本题考查元素周期律,比较基础,侧重对基础知识的巩固,掌握金属性与非金属性强弱比较及实验事实.


科目:高中化学 来源: 题型:选择题
| A. | 锌作阳极,镀件作阴极,溶液中有锌离子 | |
| B. | 铂作阴极,镀件作阳极,溶液中有锌离子 | |
| C. | 铁作阳极,镀件作阴极,溶液中有锌离子 | |
| D. | 锌作阴极,镀件作阳极,溶液中有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
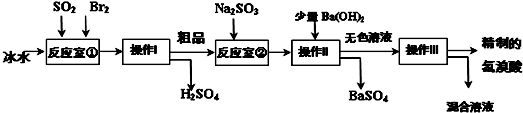
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合题中A分子结构特征的有机物有多种 | |
| B. | A在一定条件下可与4 mol H2发生加成反应 | |
| C. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 达到平衡时X浓度为0.04 mol•L-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015 mol•L-1 | |
| C. | 若升高温度,X的体积分数增大,则该反应的?△H<0 | |
| D. | 若增大压强,平衡向正反应方向移动,平衡常数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收空气中CO2 所致 | |
| B. | NaOH与玻璃作用,而后吸收CO2 所致 | |
| C. | NaOH中含有Na2CO3 | |
| D. | 溶液中的水分部分蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前后Cu2+的浓度不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+ | |
| C. | 向反应后的溶液中加入乙醇,溶液无明显变化 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com