
 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
. +
+ $\stackrel{酶}{→}$
$\stackrel{酶}{→}$ +H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式
+H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式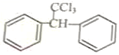 .
.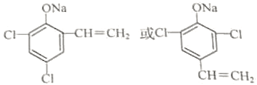 (任写一种)
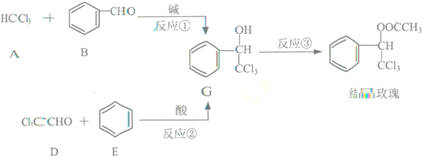
(任写一种) 分析 (1)A的俗称是氯仿,D中官能团为醛基、氯原子;对比D、E、G的结构可知反应②为取代反应;
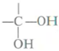
(2)G与氢氧化钠溶液反应发生水解反应,再脱去1分子水生成形成羧基,羧基去氢氧化钠发生中和反应;
(3)已知: +
+ $\stackrel{酶}{→}$
$\stackrel{酶}{→}$ +H2O,可推知反应②中副产物为苯环取代G中羟基;
+H2O,可推知反应②中副产物为苯环取代G中羟基;
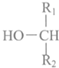
(4)G的同分异构体L遇FeCl3溶液显色,说明含有酚羟基,与足量浓溴水反应未见白色沉淀产生,说明酚羟基邻位、对位没有H原子,若L与NaOH的乙醇溶液共热能反应,则L含有-CH2CH2Cl或-CHClCH3,L苯环上还含有2个-Cl,L与NaOH的乙醇溶液共热时,羟基发生反应,还发生卤代烃的消去反应;
解答 解:(1)A的俗称是氯仿,D中官能团为醛基、氯原子;对比D、E、G的结构可知反应②为加成反应,
故答案为:氯仿;醛基、氯原子;加成反应;
(2)G与氢氧化钠溶液反应发生水解反应,再脱去1分子水生成形成羧基,羧基去氢氧化钠发生中和反应,反应方程式为: ,
,
故答案为: ;
;
(3)已知: +
+ $\stackrel{酶}{→}$
$\stackrel{酶}{→}$ +H2O,可推知反应②中副产物为苯环取代G中羟基,结构简式为:
+H2O,可推知反应②中副产物为苯环取代G中羟基,结构简式为: ,
,
故答案为: ;
;
(4)G的同分异构体L遇FeCl3溶液显色,说明含有酚羟基,与足量浓溴水反应未见白色沉淀产生,说明酚羟基邻位、对位没有H原子,若L与NaOH的乙醇溶液共热能反应,则L含有-CH2CH2Cl或-CHClCH3,L苯环上还含有2个-Cl,L与NaOH的乙醇溶液共热时,羟基发生反应,还发生卤代烃的消去反应,生成物的结构简式为: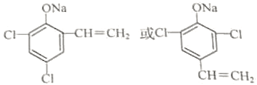 ,
,
故答案为: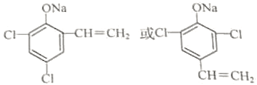 .
.
点评 本题考查有机物的合成、官能团的结构与性质、同分异构体书写、对信息的迁移应用等,注意根据有机物的结构与给予的信息进行分析,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | HCl发生还原反应 | |
| C. | 氧化性KClO3>Cl2 | |
| D. | 被还原的物质是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA | |
| B. | 标准状况下,2.24L乙烷含有分子的数目为0.1NA | |
| C. | 1L1mol•L-1的CuCl2溶液中含有Cu2+的数目为NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂(或条件) | ||
| A | 用温度的变化鉴别二氧化氮和溴蒸气 | ①热水浴 | ②冷水浴 |
| B | 用Na块检验乙醇分子中存在不同于烃分子里的氢原子 | ①乙醇 | ②己烷 |
| C | 用不同的有色物质比较二氧化硫和氯水漂白性的差异 | ①石蕊 | ②品红 |
| D | 用溴水检验苯的同系物中烷基对苯环有影响 | ①苯 | ②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲的非金属性最强 | |
| B. | 戊的最高价氧化物的水化物酸性最强 | |
| C. | 原子半径大小为:乙>丙>甲 | |
| D. | 乙分别与甲、丙形成晶体M、N的熔点大小为:M<N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
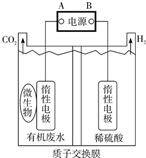 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )| A. | 电极A为负极 | |
| B. | 电解中生成的CO2与H2物质的量之比为1:1 | |
| C. | 阳极反应为:CH3COOH一8e-+8OH-═2CO2↑+6H2O | |
| D. | 电解前后,阴极室的pH几乎保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯、裂化汽油、溴苯、福尔马林 | |
| B. | 乙醇、乙酸、乙醛、乙苯 | |
| C. | 苯甲酸溶液、甘油、甲苯、甲酸 | |
| D. | 苯酚、苯乙烯、苯、1,2-二溴乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com