
| 高温 |
| ||

| 高温 |
| ||
| 高温 |
| ||
| ||
| ||
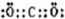 ,为直线型分子,故答案为:
,为直线型分子,故答案为: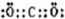 ;
;

科目:高中化学 来源: 题型:
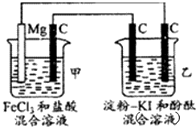
| A、甲池中Mg极为阳极,电极反应式为:Mg-2r-═Mg2+ |
| B、甲池中:当Mg减少2.4g时,石墨(C)极上产生2.24L气体 |
| C、乙池中将化学能转化为电能 |
| D、乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、①③④⑥ |
| C、①④⑥ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组 别 | 碳原子数 | ||
| A | B | C | |
| ① | 3 | 3 | 6 |
| ② | 3 | 3 | 4 |
| ③ | 1 | 4 | 5 |
| ④ | 2 | 4 | 4 |
| ⑤ | 5 | 2 | 7 |
| ⑥ | 2 | 2 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
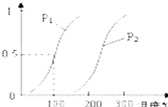 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
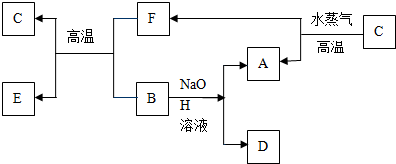
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com