
科目:高中化学 来源: 题型:选择题
| A. | 该实验需要用的主要玻璃仪器有:两个大小相同的烧杯、两只大小相同的量筒、温度计、环形玻璃搅拌棒 | |
| B. | 能用保温杯代替烧杯做有关测定中和热的实验 | |
| C. | 该实验至少需要测定并记录温度的次数是3次 | |
| D. | 若NaOH的物质的量稍大于HCl,会导致所测中和热数值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下式所示的氧化还原反应设计一个原电池:Fe+2Fe3+═3Fe2+
根据下式所示的氧化还原反应设计一个原电池:Fe+2Fe3+═3Fe2+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
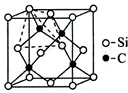 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若pH=7,c(HA)=0.1 mol/L | |
| B. | 若pH<7,微粒浓度关系可能为:c(Na+)=c(HA)+c(A-) | |
| C. | 若pH>7,c(A-)>c(Na+) | |
| D. | 若pH=12,且HA为强酸时,c(HA)=0.08 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中或熔融状态下均不导电的化合物叫非电解质 | |
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 | |
| C. | 电解质在水中一定能导电,在水中导电的化合物一定是电解质 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com