
【题目】如图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
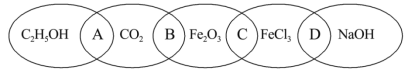
(1)两种物质都是氧化物的是____(填分类标准代号),写出酸性氧化物与少量NaOH溶液反应的化学方程式____。
(2)分类标准代号A表示___(多项选择)。
a.两物质都是非电解质
b.两物质都是有机物
c.两物质都是含碳化合物
d.两物质都是氧化物
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,该反应的化学方程式为____。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为___,该反应的化学方程式为____。
【答案】B CO2+NaOH=NaHCO3 a、c Fe2O3+6HCl=2FeCl3+3H2O 胶体 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
【解析】
(1)乙醇是有机物,二氧化碳是酸性氧化物,氧化铁是碱性氧化物,氯化铁是盐,氢氧化钠是碱。所以两种物质都是氧化物的是B。CO2与NaOH溶液反应,当CO2少量时生成酸式盐,化学方程式为:CO2+NaOH=NaHCO3。故答案为:B,CO2+NaOH=NaHCO3。
(2)二氧化碳是非电解质,不是有机物,含碳元素,是氧化物。乙醇也是非电解质,是有机物,含碳元素,不是有机物,所以选a、c。
(3)Fe2O3和盐酸反应生成FeCl3,故答案为:Fe2O3+6HCl=2FeCl3+3H2O。
(4)氢氧化铁胶体的制备是向25 mL蒸馏水中加入5~6滴FeCl3饱和溶液,加热至红褐色,就得到了氢氧化铁胶体。反应的化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。


科目:高中化学 来源: 题型:
【题目】通常塑料容器的底部都有一个小小身份证 —— 一个三角形的符号,三角形里边有1~7数字,每个编号各代表一种塑料材质(如下所示)。

(1) 2-6号塑料属于聚烯烃材质。聚烯烃的生成过程中,形成了新的___(填写 “C-C键”或“C-H键”),发生了_____反应(填反应类型)。
(2) 1号塑料的材质是聚对苯二甲酸乙二醇酯,简称PET。结构简式如图所示:

比较1-6号塑料的结构,推测哪种材质更易开发成可降解塑料,请解释原因_______
PET的合成路线如下所示:

(3) 有机物B中除了苯基,还含有的官能团是___________。
(4) 工业生产中,乙烯制备乙二醇采用乙烯氧化法(如上图表示)。设计另一条由乙烯为原料制得乙二醇的合成方案,写出这种方法所涉及的化学方程式(无机试剂任选)。_____
(5) 通过两种途径的比较,解释工业生产选用乙烯氧化法的原因(从原料成本、环境污染和原子利用率3个角度评价)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在汽车尾气处理装置中加入适当的催化剂,能发生如下反应:4CO+2NO2![]() 4CO2+N2。下列对该反应的说法中错误的是
4CO2+N2。下列对该反应的说法中错误的是
A. 该反应是氧化还原反应
B. 该反应中氧化剂是CO、还原剂是NO2
C. 该反应生成28 g N2时,转移8 mol e-
D. 该反应将能减少汽车尾气对环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铼熔点高、耐磨、耐腐蚀,广泛用于航天航空等领域。工业上用富铼渣(含ReS2)制得铼粉,其工艺流程如下图所示:
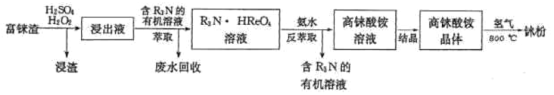
回答下列问题
(1)下图是矿样粒度与浸出率关系图,浸出时应将富铼渣粉碎至___________目;请给出提高铼浸出率的另外两种方法:___________。浸出反应中ReS2转化为两种强酸,请写出铼浸出反应的离子方程式:______________________。

(2)上图表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取剂流速宜选用的范围是___________BV/h。
(3)已知高铼酸铵不溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是___________。
(4)高铼酸铵热分解得到Re2O7,写出氢气在800℃时还原Re2O7制得铼粉的化学方程式______________________。
(5)整个工艺流程中可循环利用的物质有:H2SO4、___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是
p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是

A. T1<T2,P1>P2,m+n>p,△H<0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1<T2,P1>P2,m+n<p,△H<0
D. T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 0.2L 3mol·L-1的NH4Cl溶液与0.3L2mol·L-1的NH4Cl溶液中NH4+的数目均为0.6NA
B. 标准状况下,11.2L乙烯和环丙烷的混合气体中,共用电子对的数目为3NA
C. 常温下,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
D. ag某气体所含分子数为b个,则cg该气体的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制硝酸的主要反应是4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________;升高温度,K值______(填“增大”或“减小”或 “不变”);升高温度,化学反应速率将______(填“增大”或“减小” 或 “不变”)。
(2)若反应物起始的物质的量相同,下列关系图正确的是______(填序号)。
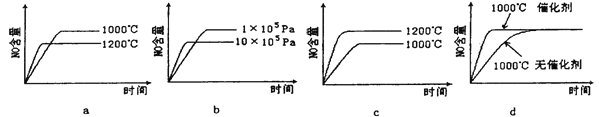
(3)若达到平衡状态后升高温度则正反应速率和逆反应速率___________________ 。(填“同时增大”或“逆反应速率增大,正反应速率不变”)
(4)工业上合成氨气的反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0 ,在密闭容器中反应达到平衡状态的标志是_______。
2NH3(g)ΔH<0 ,在密闭容器中反应达到平衡状态的标志是_______。
①压强不再改变
②生成氨气的速率等于生成氮气的速率
③正反应速率等于零
④容器内气体的平均相对分子量不再改变
⑤单位时间内有3amolH-H的断裂的同时有6amolN-H断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的正确判断是( )
A. 在pH=12的溶液中,K+、Cl﹣、HCO3﹣、Na+可以大量共存
B. 在pH=0的溶液中,Na+、NO3﹣、SO32﹣、K+可以大量共存
C. 由0.1molL﹣1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH﹣
D. 由0.1molL﹣1一元酸HA溶液的pH=3,可推知NaA溶液存在A﹣+H2OHA+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________________________。
(2)下图为N2(g)和O2(g)生成NO (g)过程中的能量变化:
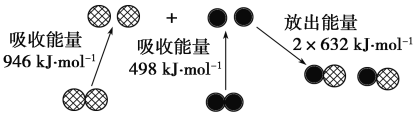
则N≡N键的键能为________kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:_____________________________________________________________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:________________________________________________________________________。
(4)接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190 kJ·mol-1。
2SO3(g) ΔH=-190 kJ·mol-1。
①该热化学反应方程式的意义是___________________________________________________
②已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com