
| N |
| NA |
| m |
| n |
| 3.01×1023 |
| 6.02×1023mol-1 |
| 22g |
| 0.5mol |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、由水电离的c(H+)=10-4mol/L的溶液中:Fe2+、SO42-、K+、NO3- | ||
| B、由水电离的c(H+)=10-14mol/L的溶液中:Ca2+、Na+、HCO3-、NO3- | ||
C、
| ||
| D、c(Fe3+)=0.1mol/L的溶液中:Na+、K+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用块状固体反应物代替粉末状反应物 |
| B、提高设备抗压强度以便加压 |
| C、采用高温高压的反应条件 |
| D、选择合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
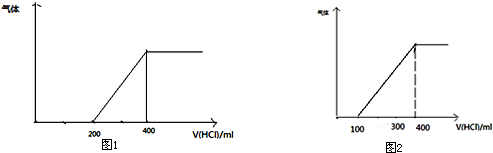
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com