
 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: .
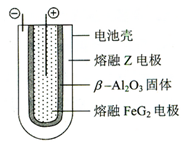
. 2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极. 分析 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素;G是短周期主族元素,所以G是Cl元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)NaH属于离子化合物,用Na原子、H原子电子式表示其形成;
(3)非金属性越弱,氢化物的还原性越强;
(4)氯气、臭氧、ClO2等可以杀菌消毒;
(5)放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe;充电时为电解池,阴极发生还原.
解答 解:X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素;G是短周期主族元素,所以G是Cl元素.
(1)Y为O元素,原子核外有2个电子层,最外层电子数为6,在元素周期表中的位置为:第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)ZX为NaH,用电子式表示形成过程为: ,
,
故答案为: ;
;
(3)S元素非金属性最弱,非金属气态氢化物还原性最强的是H2S,与水分子构型类似,其空间构型为V形,
故答案为:H2S;V形;
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有:Cl2、O3、ClO2等
故答案为:Cl2、O3等;
(5)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2  Fe+2NaCl. 放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时为电解池,阴极发生还原,故Na电极接电源的负极,
Fe+2NaCl. 放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时为电解池,阴极发生还原,故Na电极接电源的负极,
故答案为:Fe2++2e-=Fe;钠.
点评 本题以元素推断为载体考查了元素化合物的结构与性质、常用化学用语、电化学知识等,能正确判断元素是解本题的关键,注意(2)中NaH电子式书写氢负离子的电子式2个电子成对,不能分开.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2 | B. | FeCl2 | C. | 稀盐酸 | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钡与盐酸反应 2H++BaCO3=Ba2++H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸混合 Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| C. | 氯气通入蒸馏水中 Cl2+H2O=Cl-+ClO-+2 H+ | |
| D. | CO2通入过量的澄清石灰水中 CO2+Ca(OH)2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水产生具有吸附性的胶体粒子,可杀菌消毒 | |
| B. | 氯水可使有色布条褪色,说明氯气具有漂白性 | |
| C. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| D. | 碳素钢和光导纤维都属于新型的无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com