
【题目】某科技小组利用NaClO, NaClO2复合吸收剂研究烟气脱硫脱硝技术.
(1)随着pH值的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是_________。
(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:
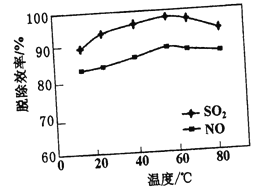
随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有____、_____。
(3)在脱硫脱硝过程中存在ClO2、ClO2-和ClO3-,它们的含量可采用连续碘量滴定法测定。已知:碘量法的瘾定反应为I2+2S2O32-=2I-+S4O62-。
实验方法:取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol/LNa2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:
实验 | pH | 反应 | Na2S2O3溶液体积/mL |
① | pH=7.0 | 2C1O2+2I-=I2+2ClO2- | V1 |
② | pH=4.0 | ClO2-+4I-+4H+=2I2+Cl-+2H2O | V2 |
③ | pH<0.1 | ClO3-+6I-+6H+=3I2+Cl-+3H2O 2ClO2+10I-+8H+=5I2+2Cl-+4H2O ClO2-+4I-+4H+=2I2+Cl-+2H2O | V3 |
注:实验②控制pH前先鼓入氮气以除去ClO2。
计算试样中ClO3-的浓度为多少mg/L(写出计算过程,用含V1、V2、V3、V的代数式表示)_____.
【答案】 吸收液的氧化性随着pH的增加而降低 温度升高反应速率增大或温度升高能提高吸收液的氧化能力 温度过高会使气体的溶解度降低 三次滴定消耗的S2O32-的物质的量依次为10-5V1mol、10-5V2mol、10-5V3mol
由实验①可知:2ClO2————I2————2S2O32-
10-5V1mol 10-5V1mol
由实验②可知:ClO2-————2I2————4S2O32-
2.5×10-6V2mol 10-5V2mol
由实验③可知; 2ClO2————5I2————10S2O32-
10-5V1mol 5×10-5V1mol
ClO2-————2I2————4S2O32-
2.5×10-6V2mol 10-5V2mol
实验③中测定ClO3-需要S2O32-的物质的量为(10-5V3-5×10-5V1-10-5V2) mol
由ClO3-——3I2——6S2O32-可知:
n(ClO3-)=1/6(10-5V3-5×10-5V1-10-5V2)mol
试样中ClO3-的浓度为
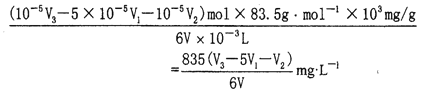
【解析】(1)NaClO和NaClO2,在酸性条件下的氧化性较强,脱硫和脱硝的效率高,随着pH值的增大,NaClO和NaClO2的氧化性减弱,导致烟气脱硫和脱硝效率均呈下降趋势。答案为:吸收液的氧化性随着pH的增加而降低。
(2)升高温度可加快反应速率,提高吸收液的氧化能力,从而导致脱硫和脱硝的效率增加,但温度过高会使气体的溶解度降低,吸收液的氧化能力减弱,从而使脱硫和脱硝的效率减小。答案为:温度升高反应速率增大或温度升高能提高吸收液的氧化能力、温度过高会使气体的溶解度降低
(3) 由实验①可知ClO2消耗Na2S2O3溶液的体积,由实验②可知ClO2-消耗Na2S2O3溶液的体积,由实验③消耗Na2S2O3溶液的总体积减去实验①和②消耗Na2S2O3溶液的体积,就可求得ClO3-消耗Na2S2O3溶液的体积,从而可知ClO3-的物质的量,并求出浓度。计算过程如下:
三次滴定消耗的S2O32-的物质的量依次为10-5V1mol、10-5V2mol、10-5V3mol
由实验①可知:2ClO2————I2————2S2O32-
10-5V1mol 10-5V1mol
由实验②可知:ClO2-————2I2————4S2O32-
2.5×10-6V2mol 10-5V2mol
由实验③可知; 2ClO2————5I2————10S2O32-
10-5V1mol 5×10-5V1mol
ClO2-————2I2————4S2O32-
2.5×10-6V2mol 10-5V2mol
实验③中测定ClO3-需要S2O32-的物质的量为(10-5V3-5×10-5V1-10-5V2) mol
由ClO3-——3I2——6S2O32-可知:
n(ClO3-)=1/6(10-5V3-5×10-5V1-10-5V2)mol
试样中ClO3-的浓度为
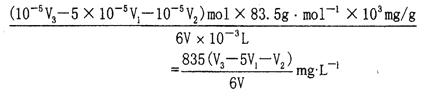
答案为:三次滴定消耗的S2O32-的物质的量依次为10-5V1mol、10-5V2mol、10-5V3mol
由实验①可知:2ClO2————I2————2S2O32-
10-5V1mol 10-5V1mol
由实验②可知:ClO2-————2I2————4S2O32-
2.5×10-6V2mol 10-5V2mol
由实验③可知; 2ClO2————5I2————10S2O32-
10-5V1mol 5×10-5V1mol
ClO2-————2I
2.5×10-6V2mol 10-5V2mol
实验③中测定ClO3-需要S2O32-的物质的量为(10-5V3-5×10-5V1-10-5V2) mol
由ClO3-——3I2——6S2O32-可知:n(ClO3-)=1/6(10-5V3-5×10-5V1-10-5V2)mol
试样中ClO3-的浓度为


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】有下列8种物质,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
①甲烷②苯③聚乙烯④1,3-丁二烯⑤2-丁炔⑥邻二甲苯⑦乙醛⑧环己烯.
A. ①③④⑤⑧B. ①④⑤⑧C. ④⑤⑦⑧D. ①③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①丁烷 ②2-甲基丙烷 ③戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷沸点由大到小的排列顺序正确的是( )
A. ①>②>③>④>⑤B. ⑤>④>③>②>①
C. ③>④>⑤>①>②D. ②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH客液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:________。
②b点时溶液中c(H2N2O2)________c(N2O22-)。(填“>”“<”或“=”下同)
③a点时溶液中c(Na+)________c(HN2O2-)+c(N2O22-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是( )
A.K+ MnO4- Cl- SO42-B.Na+ K+ Al3+ Ba2+
C.Na+ HCO3- NO3- SO42-D.Na+ SO42- S2- Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com