
| A. | Cu和Fe相连插入某溶液中形成原电池,则Fe一定作负极 | |
| B. | MgCl2中混有少量的FeCl3,可以通过溶解,加入过量MgO、过滤、结晶等操作进行提纯 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明阴极只有Cu2+被还原 | |
| D. | 将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,最后可能只有Fe剩余 |
分析 A、Cu和Fe相连插入某溶液中形成原电池,如果电解质是浓硫酸,因为铁在浓硫酸中发生钝化,所以铜作负极;
B、MgCl2+2H2O?Mg(OH)2+2HCl;FeCl3+3H2O?Fe(OH)3+3HCl(水解),MgO吸收H+,生成MgCl2,溶液酸性减弱,由于FeCl3在PH=3-4,便开始水解,在PH=4几乎水解完全,即除去FeCl3;
C、用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明溶质和溶剂都放电;
D、将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,铜离子的氧化性强,所以铁首先与铜离子发生氧化还原反应,生成单质铜,所以剩余固体中一定有铜.
解答 解:A、Cu和Fe相连插入某溶液中形成原电池,如果电解质是浓硫酸,因为铁在浓硫酸中发生钝化,所以铜作负极,随反应的进行,浓硫酸变稀硫酸,铁作负极,故A错误;
B、MgCl2+2H2O?Mg(OH)2+2HCl;FeCl3+3H2O?Fe(OH)3+3HCl(水解),MgO吸收H+,生成MgCl2,溶液酸性减弱,由于FeCl3在PH=3-4,便开始水解,在PH=4几乎水解完全,即除去FeCl3,故B正确;
C、用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明溶质和溶剂都放电,所以阴极还有H+被还原,故C错误;
D、将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,铜离子的氧化性强,所以铁首先与铜离子发生氧化还原反应,生成单质铜,所以剩余固体中一定有铜,故D错误;
故选B.
点评 本题考查电化学的反应原理以及通过平衡的移动来分析除杂的相关知识,有一定的难度,特别是B选项中的除杂问题.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热/kJ•mol-1 | 化合物 | 燃烧热/kJ•mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 异戊烷 | 3531.3 |
| A. | 正戊烷的燃烧热小于3531.3kJ•mol-1 | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);△H=-1560.8 kJ | |
| D. | 相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为单质铝,则Y的气体产物只能是氢气 | |
| B. | 若X为NaHCO3,则Z一定有CO2 | |
| C. | 若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3 | |
| D. | 若X为乙酸乙酯,则生成物Y、Z中均含有乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 2:3:6 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
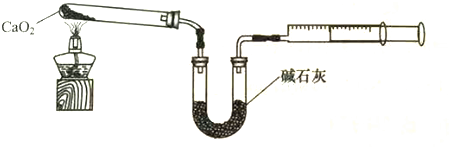
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列关于烷烃性质的叙述中,不正确的是( )
A.烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高
B.烷烃都能使溴水、酸性KMnO4溶液褪色
C.烷烃跟卤素单质在光照条件下能发生取代反应
D.烷烃同系物的密度随着相对分子质量的增大逐渐增大
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:推断题
有机化学推断题:
DEET又名避蚊胺,化学名为N,N-二乙基间甲苯甲酰胺,其结构简式为: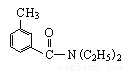 ;DEET在一定条件下,可通过下面的路线来合成:
;DEET在一定条件下,可通过下面的路线来合成:

已知:RCOOHRCOCl(酰氯,化学性质十分活泼);
RCOCl+NH3→RCONH2+HCl
根据以上信息回答下列问题:
(1)由DEET的结构简式推测,下列叙述正确的是 。(填字母)
A.它能使酸性高锰酸钾溶液褪色
B.它能发生酯化反应
C.它与甲苯互为同系物
D.一定条件下,它可与H2发生加成反应
(2)B的结构简式为 。
(3)在反应④~⑦中,属于取代反应的有 (填序号)。
(4)写出C→DEET的化学反应方程式 。
(5)E的同分异构体中能与FeCl3溶液发生显色反应,且不含乙基的有机物共有 种。
(6)经核磁共振氢谱图显示,A的某种同分异构体J只有两个吸收峰,试写出J的化学名称 ;J物质被酸性高锰酸钾氧化后得到的产物在一定条件下可与乙二醇反应,制成当前合成纤维的第一大品种涤纶(聚酯纤维),试写出生产涤纶的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com