
| A. | 摩尔质量:26 | B. | 球棍模型: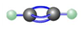 | C. | 电子式: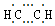 | D. | 结构式:CH≡CH |
分析 A、摩尔质量的单位为g/mol;
B、乙炔中的C原子的半径大于H原子半径;
C、C、H之间形成1对共用电子对,C、C之间形成3对共用电子对;
D、乙炔的结构式中是两个C原子之间形成碳碳三键.
解答 解:A、一种物质的摩尔质量在数值上等于该物质的相对分子质量,且摩尔质量的单位为g/mol,故乙炔的摩尔质量为26g/mol,故A错误;
B、乙炔中的C原子的半径大于H原子半径,故乙炔的球棍模型为 ,故B正确;
,故B正确;
C、C、H之间形成1对共用电子对,C、C之间形成3对共用电子对,其电子式为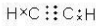 ,故C错误;
,故C错误;
D、乙炔的结构式中是两个C原子之间形成碳碳三键,而不是H原子与C原子形成三键,故结构式为H-C≡C-H,故D错误.
故选B.
点评 本题考查化学用语,为高频考点,把握乙炔的结构、电子式的书写为解答的关键,侧重分析与应用算能力的考查,注意乙炔中C与C之间的电子对,题目难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室中将钠保存于煤油或石蜡油中 | |
| B. | 金属镁着火使用泡沫灭火器灭火 | |
| C. | 用湿润的淀粉-KI试纸鉴别NO2和溴蒸气 | |
| D. | 配制一定物质的量浓度的溶液时,向容量瓶中倒入液体至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 最高价氧化物对应水化物酸性:X>Y | |
| C. | W、X两种元素组成的化合物难溶于水 | |
| D. | W、Y、Z三种元素不能组成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
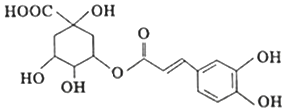
| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应,升高温度v正增大,v逆减小,平衡向正反应方向移动 | |
| B. | 若化学平衡移动了,但正、逆反应不一定都变化 | |
| C. | 正、逆反应速率都变化了,化学平衡必发生移动 | |
| D. | 石墨吸收能量后可转化为金刚石,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-O | O=O | N≡N | N-H |
| 键能KJ•mol-1 | 463 | 496 | 942 | 391 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com