
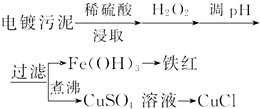
| ������ | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
| ��ʼ������pH | 2.3 | 7.6 | 4.4 |
| ��ȫ������pH | 3.2 | 9.7 | 6.4 |
���� �������̣���������к���ͭ�����Ƚ�������������ȡ������˫��ˮ�������ɵ�����ͭ���������Ļ����Һ������PHֵ��ʹ�����Ӳ��������������������˵������������壬�ٽ���������������ȷֽ�������������˵���Һ�к�������ͭ����CuSO4��Һ�м���һ������NaCl��Na2SO3����ͭ���ӻ�ԭ����ͭ���ӣ����ɰ�ɫ��CuCl������
��1������˫��ˮ�����ʷ�����˫��ˮ�������ԣ���������ԭ�Ե����ʣ����ݹ��˲�����ԭ����ʹ�õ��������з�����ɣ�
��2��CuSO4��+2�۵�ͭ����������������Na2SO3��+4�۵���
��3������ƽ�ⳣ���ĸ����Ϸ�Ӧ����ʽд��ƽ�ⳣ������ʽ��
��4�����ݹ�ϵʽ����n��CuCl��������������Ʒ��m��CuCl������һ�������CuCl��Ʒ������������
��� �⣺��1����������к���ͭ�����Ƚ���������������Ҫ���ܽ�ͭ�����Ƚ��������˫��ˮ��ǿ�����ԣ���������ԭ�Ե����ʣ�Fe2+���л�ԭ�ԣ���������H2O2��Fe2+�ܱ�˫��ˮ����Ϊ�����ӣ����ڵ���pHֵ��Cu2+���룬��pH�����м�����Լ�����Ǽ���ij�����ʳ�ȥ��Һ�е����Ҳ������µ����ʣ�����Ҫ��������ͭ����������ͭ��̼��ͭ������Һ��pHֵ4.4ʱ��ͭ���ӿ�ʼ���ֳ���������Һ��pHֵΪ3.2ʱ�����������ӳ�����ȫ��ͭ����δ��������������Ҫʹ���������Ӻ�ͭ���ӷ��룬���˲����õ�������������̨��©�����ձ����������ȣ��������ڲ��������У�©�����ձ�����������
�ʴ�Ϊ����Fe2+������Fe3+�����ڵ���pHֵ��Cu2+���룻CuO����Cu��OH��2����CuCO3��©�����ձ�����������
��2�������������ʱȽ��ȶ��������ȵ�153������ҵķֽ�Ϊˮ������������Һ�й�����H2O2 ��ȥ�ɼ������б���Ӱ����һ��CuCl�����ɣ���ΪCuSO4��+2�۵�ͭ�ܰ�Na2SO3��+4�۵���������+6�۵�����CuSO4��Һ�м���һ������NaCl��Na2SO3ʱ���ɰ�ɫ��CuCl��������Ӧ�Ļ�ѧ����ʽΪ��2CuSO4+2NaCl+Na2SO3+H2O=2CuCl��+2Na2SO4+H2SO4��
�ʴ�Ϊ��������Һ�е�H2O2������Ӱ����һ��CuCl�����ɣ�2CuSO4+2NaCl+Na2SO3+H2O=2CuCl��+2Na2SO4+H2SO4��
��3��Fe3+����ˮ�ⷴӦFe3++3H2O?Fe��OH��3+3H+������ƽ�ⳣ������ʽΪK=$\frac{c{\;}^{3}��H{\;}^{+}��}{c��Fe{\;}^{3+}��}$��
�ʴ�Ϊ��K=$\frac{c{\;}^{3}��H{\;}^{+}��}{c��Fe{\;}^{3+}��}$��
��4������Ʒ��CuCl������Ϊx���йصĻ�ѧ��ӦΪ��Fe3++CuCl=Fe2++Cu2++Cl-��Ce4++Fe2+=Fe3++Ce3+����
�ɻ�ѧ��Ӧ����ʽ��֪��CuCl������Fe2+������Ce4+
1 1
n��CuCl�� 25.00��10-3L��0.1000 mol/L
���� n��CuCl��=25.00��10-3L��0.1000 mol/L=2.50��10-3mol��
���Ը���ƷCuCl������Ϊ2.50��10-3mol��99.5g/mol=0.24875g������0.2500g����ƷCuCl����������Ϊ$\frac{0.24875g}{0.2500g}$��100%=99.50%��
�ʴ�Ϊ��99.50%��
���� ������һ��ʵ��̽���⣬�ܽϺõĿ���ѧ�������ͽ������������������˳������ʷ���ķ������ζ�����ȣ�ע��ʵ�鷽�������ԭ���Ͳ������ù�ϵʽ���㣬�������е�֪ʶ������ʼ䷴Ӧ��ʵ������������ʳɷֵ��ƶϣ��ǽ��Ĺؼ���ƽʱע������ʵ�Ļ���֪ʶ�����Ӧ��֪ʶ��������������������Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �����ܣ�KJ/mol�� | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
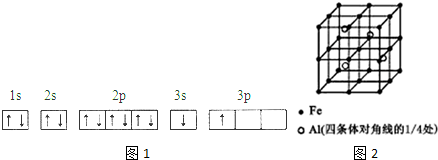
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2 | B�� | BF3 | C�� | LiCl | D�� | NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊ����ˮԡ�¶�Ϊ85��90�棬���¶ȼƲ��뷴ӦҺ�� | |
| B�� | Ϊ��ȥ��˾ƥ���л��е����ʣ����ڴֲ�Ʒ�м�����NaHCO3��Һ�����衢���ˡ�ϴ�ӳ��������T�þ�Ʒ | |
| C�� | һ�������£�1mol��˾ƥ��������2mol��NaOH��Ӧ | |
| D�� | ����FeCl3��Һ���鰢˾ƥ�����Ƿ���δ��Ӧ���ˮ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
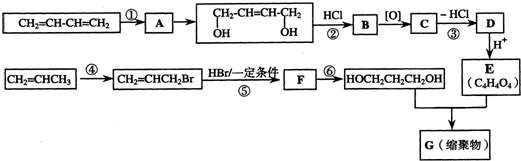
 ��д����Ӧ�Ļ�ѧ����ʽ��CH2BrCH2CH2Br+2NaOH$��_{��}^{ˮ}$HOCH2CH2CH2OH+2NaBr��
��д����Ӧ�Ļ�ѧ����ʽ��CH2BrCH2CH2Br+2NaOH$��_{��}^{ˮ}$HOCH2CH2CH2OH+2NaBr��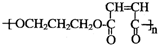 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 1 | A | |||||||
| 2 | D | E | F | G | I | |||
| 3 | B | C | H |
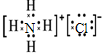 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
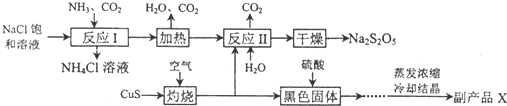
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2KOH��aq��+H2SO4��aq���TK2SO4��aq��+2H2O��l����H=-57.3 kJ/mol | |
| B�� | 2H+��aq��+SO42-��aq��+Ba2+��aq��+2OH-��aq���TBaSO4��s��+2H2O��l����H=-57.3 kJ/mol | |
| C�� | 2C8H18��g��+25O2��g���T16CO2��g��+18H2O��l����H=-5518 kJ/mol | |
| D�� | C8H18��l��+O2��g���T8CO2��g��+9H2O��l����H=-5518 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com