
| A. | 气态氢化物的稳定性:X>W | |
| B. | Y、Z、W的最高价氧化物对应水化物之间能两两反应 | |
| C. | 原子半径:Y>Z>W>X | |
| D. | 工业上获得Y、Z单质的主要方法是电解其熔融的氯化物 |
分析 X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的一种单质具有杀菌、消毒能力,单质为臭氧,X为O元素,Y单质与X单质在不同条件下反应会生成两种不同化合物,化合物为氧化钠、过氧化钠,可知Y为Na元素,Z简单离子半径是同周期元素简单离子中最小的,由原子序数可知Z位于第三周期,则Z为Al元素;W原子最外层电子数是其电子层数的2倍,最外层电子数为6,W为S元素,以此来解答.
解答 解:由上述分析可知,X为O,Y为Na,Z为Al,W为S,
A.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:X>W,故A正确;
B.Y、Z、W的最高价氧化物对应水化物分别为NaOH、氢氧化铝、硫酸,氢氧化铝具有两性,则能两两反应,故B正确;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Y>Z>W>X,故C正确;
D.Na、Al均为活泼金属,电解法可冶炼,电解熔融氯化钠、氧化铝,氯化铝为共价化合物不导电,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、元素周期律来推断元素为解答的关键,侧重分析与应用能力的考查,注意短周期元素的限制条件及规律性知识的应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 棉花、蚕丝和人造丝的主要成分都是纤维素 | |
| B. | 二氧化硫的排放是造成光化学烟雾的主要因素 | |
| C. | 雨水样品一段时间后,pH由4.68变为4.28,是因为雨水中溶解了较多的氮氧化物和CO2 | |
| D. | “毒奶粉”中含有的三聚氰胺(C3H6N6)属有机物,其含氮量远高于奶粉的含氮量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的$\frac{1}{4}$,C元素的最高价氧化物的水化物是一种中强碱.甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )
A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的$\frac{1}{4}$,C元素的最高价氧化物的水化物是一种中强碱.甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )| A. | C、D两元素形成化合物属共价化合物 | |
| B. | A、D分别与B元素形成的化合物都是大气污染物 | |
| C. | C、D的简单离子均能促进水的电离 | |
| D. | E的氧化物水化物的酸性大于D的氧化物水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然 后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤, 向洗净的沉淀中加稀盐酸,有气泡产生 |
| D | 通过观察液面差判断该装置的气密性 | 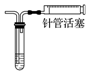 向里推注射器 向里推注射器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与C10H12O3一定互为同系物 | B. | 能发生酯化、加成、水解等反应 | ||
| C. | 苯环上一硝基取代产物有3种 | D. | 所有碳原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点:c(H+)>c(Cl-)>c(ClO-) | |
| B. | b点:$\frac{1}{2}$ c(Cl-)═c(SO42-)=0.005mol•L-1 | |
| C. | c点:c(Na+)═2c(HSO3-)+2c(SO32-) | |
| D. | d 点:c(Na+)═c(Cl-)+c(HSO3-)+2c(SO32-)+2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
| 30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最低 | |
| B. | 电离能最小的电子能量最高 | |
| C. | p轨道电子能量一定高于s轨道电子能量 | |
| D. | 在离核最远区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象或结果 | |
| A | 取混合溶液加入淀粉溶液 | 溶液变蓝 |
| B | 取混合溶液加入BaCl2溶液 | 有白色沉淀 |
| C | 测通入前后溶液的pH | pH减小 |
| D | 取混合溶液加入AgNO3溶液 | 有黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com