
 $→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$
$→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$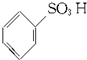
 $\stackrel{Fe,HCl,H_{2}O}{→}$
$\stackrel{Fe,HCl,H_{2}O}{→}$
 $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$

 C
C D
D .
. 分析 由信息反应③可知,反应使用NaClO,NaClO具有强氧化性,由信息反应②可知,苯胺易被氧化,故合成路线中应先发生反应③类型的转化,后发生反应②类型的转化,故结合反应路线可知,A生成B发生硝化反应,B生成C发生反应①类型的转化,C生成D发生反应③类型的转化,D生成DSD酸发生反应②类型的转化,由DSD酸的结构,利用倒推法确定各物质的结构.
解答 解:由信息反应③可知,反应使用NaClO,NaClO具有强氧化性,由信息反应②可知,苯胺易被氧化,故合成路线中应先发生反应③类型的转化,后发生反应②类型的转化,故结合反应路线可知,A生成B发生硝化反应,B生成C发生反应①类型的转化,C生成D发生反应③类型的转化,D生成DSD酸发生反应②类型的转化,由DSD酸的结构,可知D为 ,故C为
,故C为 ,B为
,B为 ,A为
,A为 ,
,
故答案为: ;
; ;
; .
.
点评 本题考查有机物的推断与合成,题目给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1moLAl3+离子含有的电子数为3NA | |
| B. | 1moLCl2含有1NA个原子 | |
| C. | 78g过氧化钠固体中,含有1NA个阴离子 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L 水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg(OH)2悬浊液中滴加浓的NH4Cl溶液,沉淀溶解:Mg(OH)2+2H+═2H2O+Mg2+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅2NO2 (红棕色,g)?N2O4(无色,g)△H<0 | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 将饱和FeCl3溶液滴入沸水并煮沸至红褐色:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 北斗卫星导航系统是中国自行研制的全球卫星定位与通信系统.发射北斗卫星的火箭推进器中的反应方程式为C2H8N2+2N2O4═2CO2+3N2+4H2O.其中N2O4是( )
北斗卫星导航系统是中国自行研制的全球卫星定位与通信系统.发射北斗卫星的火箭推进器中的反应方程式为C2H8N2+2N2O4═2CO2+3N2+4H2O.其中N2O4是( )| A. | 既是氧化剂又是还原剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅晶体、食盐、干冰 | B. | 冰、石墨、金属钠 | ||
| C. | 碘、碳酸钙、金刚石 | D. | HF、HBr、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com