
【题目】计算并填空:(在标准状况下15gCO与CO2的混合气体,体积为11.2L,则:
(1)混合气体的平均摩尔质量是 ___________________g/mol
(2)CO的体积分数是___________________
(3)CO2与CO的质量比是 ____________________________
(4)混合气体中所含碳原子的质量是 ___________________ g
【答案】30 87.5% 11:49 6
【解析】
设CO与CO2物质的量分别为:xmol和ymol,28x+44y=15,(x+y)×22.4=11.2;解之得:x=7/16mol,y=1/16mol;
(1)混合气体的平均摩尔质量是![]() =m(总)/n(总) =15/(11.2/22.4)= 30 g/mol ;综上所述,本题答案是:30。
=m(总)/n(总) =15/(11.2/22.4)= 30 g/mol ;综上所述,本题答案是:30。
(2)CO的体积分数等于气体的物质的量分数=(7/16)/((11.2/22.4)×100%=87.5%;综上所述,本题答案是:87.5%。
(3)CO2与CO的质量比:44×1/16:28×7/16=11:49;综上所述,本题答案是:11:49。
(4)混合气体中所含碳原子的物质的量为(7/16+1/16)mol=0.5 mol,所含碳原子的质量是0.5×12=6g;综上所述,本题答案是:6。


科目:高中化学 来源: 题型:
【题目】在固态金属氧化物燃料电解池中,以H2—CO混合气体为燃料,基本原理如右图所示。下列说法不正确的是
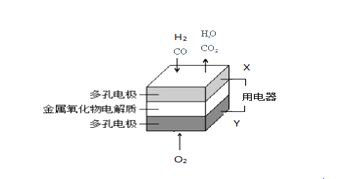
A. Y极是原电池的正极,发生还原反应
B. 负极的电极反应式是:H2-2eˉ+O2ˉ=H2O CO-2eˉ+O2ˉ= CO2
C. 总反应可表示为:H2+CO+O2 = H2O+CO2
D. 同温同压下两极消耗的气体的体积之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A. 该原子的摩尔质量是a NA B. W g该原子的物质的量是:W/(aNA)mol
C. W g该原子中含有W/a个该原子 D. 由已知信息可得: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ. NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,
N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
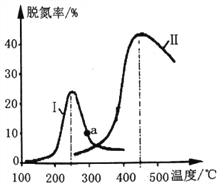
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2![]() SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
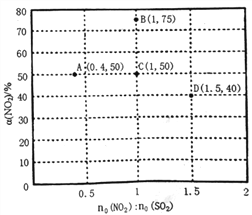
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的![]() =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是
A. O2和O3 B. CH3CH2CH2CH3和CH(CH3)3
C. 12C和13C D. CH3和CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、氧和铝是地球上极为丰富的元素。请回答下列问题:
(1)X+中所有电子恰好充满K、L、M3个电子层。
①X+与N3-形成的晶体结构如图所示。X原子的原子序数是____;基态N3-的电子排布式为______;与N3-等距离且最近的X+有______个。

②X2+和Zn2+分别可与NH3形成[X(NH3)4]2+、[Zn(NH3)4]2+,两种配离子中提供孤电子对的原子均为_______(写元素名称)。已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,而[X(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,则[X(NH3)4]2+的空间构型为_______;[Zn(NH3)4]2+中Zn的杂化类型为_______________。
(2)铝的最高价氧化物的水化物有两性,根据对角线规则写出BeO与NaOH溶液反应的离子方程式_____________________________。次碘酸也有两性,写出次碘酸与盐酸反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2K2CrO4+H2SO4![]() K2Cr2O7+K2SO4+H2O
K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4![]() 3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI![]() 2FeSO4+I2+H2SO4
2FeSO4+I2+H2SO4
下列结论正确的是
A. ①②③均是氧化还原反应
B. 氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C. 反应②中氧化剂与还原剂的物质的量之比为6∶1
D. 反应③中0.1 mol还原剂共失去电子数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com