
分析 C与E、D与E产生气体,五种物质中,能与两种物质的产生气体的只有K2CO3,则E为K2CO3,则C、D为HNO3、HCl中的物质,而D与B能产生沉淀,则D为HCl,能与硝酸银产生AgCl沉淀,所以C为HNO3,B为AgNO3,则A为BaCl2,结合物质的性质,可写出反应的离子方程式,以此解答该题.
解答 解:C与E、D与E产生气体,五种物质中,能与两种物质的产生气体的只有K2CO3,则E为K2CO3,则C、D为HNO3、HCl中的物质,而D与B能产生沉淀,则D为HCl,能与硝酸银产生AgCl沉淀,所以C为HNO3,B为AgNO3,则A为BaCl2,
(1)由以上分析可知A为BaCl2,E为K2CO3,故答案为:BaCl2;K2CO3;
(2)A为BaCl2,E为K2CO3,二者反应生成BaCO3,反应的离子方程式为Ba2++CO32-=BaCO3↓,
B为AgNO3,E为K2CO3,二者反应生成Ag2CO3,反应的离子方程式为2Ag++CO32-=Ag2CO3↓,
C为HNO3,E为K2CO3,二者反应生成CO2,反应的离子方程式为2H++CO32-=CO2↑+H2O,
故答案为:Ba2++CO32-=BaCO3↓;2Ag++CO32-=Ag2CO3↓;2H++CO32-=CO2↑+H2O.
点评 本题考查无机物的推断以及离子方程式的书写,为高频考点,侧重于学生的分析能力的考查,题目难度中等,解答本题时注意把握物质的性质,结合反应现象推断.


科目:高中化学 来源: 题型:填空题
 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuSO4、Fe2(SO4)3、盐酸.按要求回答下列问题:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuSO4、Fe2(SO4)3、盐酸.按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在原电池中做正极被保护 | |
| B. | 原电池中阴离子向负极移动 | |
| C. | 常温下,强酸强碱在稀溶液中反应的中和热是-57.3KJ.mol-1 | |
| D. | 用惰性电极电解CuSO4溶液,外电路中每通过1mol电子,溶液中就产生1mol H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢化物稳定性C>D>B | |
| B. | BC2与DC2两种气体都能与CaCl2溶液反应产生沉淀 | |
| C. | B、C、D三种元素组成的含氧酸根至少有4种 | |
| D. | Cu单质与A的氧化物、B的氧化物、C单质能生成一种新物质碱式碳酸铜,该反应属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质一定是离子化合物,弱电解质一定是共价化合物 | |
| B. | 强电解质一定是易溶化合物,弱电解质一定是难溶化合物 | |
| C. | SO3溶于水后水溶液导电性很强,所以SO3是强电解质 | |
| D. | 强电解质与弱电解质的本质区别是在水溶液中能否完全电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
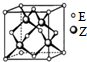 X、Y、Z、R、W、E为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
X、Y、Z、R、W、E为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为90 | B. | 中子数为38 | C. | 电子数为52 | D. | 质量数为90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com