
【题目】某温度下,在![]() 的密闭容器中发生反应:
的密闭容器中发生反应:![]() ,当加入
,当加入![]() 和
和![]() 达平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入
达平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入![]() ,再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
,再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2 B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1 D. 第二次平衡时,Z的浓度为![]()
【答案】D
【解析】A.平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变,说明反应前后气体计量数之和不变,所以m=2,故A正确;B.平衡常数只与温度有关,温度不变,平衡常数不变,所以两次平衡的平衡常数相同,故B正确;C.设第一次达到平衡状态时X参加反应的物质的量为amol,
X(g)+2Y(g) ![]() 3Z(g)
3Z(g)
开始(mol) 1 2 0
转化(mol)a 2a 3a
平衡(mol)(1-a) (2-2a) 3a
相同条件下,气体的体积与物质的量成正比,所以其体积分数等于其物质的量分数,即(1-a):(2-2a):3a=30%:60%:10%,所以a=0.1,则参加反应的△n(X)=0.1mol、△n(Y)=0.2mol,转化率=![]() ×100%,X的转化率=
×100%,X的转化率=![]() ×100%=10%,Y的转化率=
×100%=10%,Y的转化率=![]() ×100%=10%,所以X和Y的转化率之比为1:1,故C正确;D.该反应的反应前后气体计量数之和不变,第一次反应是按照X、Y的计量数之比来投料,所以第二次平衡与第一次平衡是等效平衡,两次平衡后各物质的含量不变,投入Z后,设Z参加反应的物质的量为3bmol,
×100%=10%,所以X和Y的转化率之比为1:1,故C正确;D.该反应的反应前后气体计量数之和不变,第一次反应是按照X、Y的计量数之比来投料,所以第二次平衡与第一次平衡是等效平衡,两次平衡后各物质的含量不变,投入Z后,设Z参加反应的物质的量为3bmol,
X(g) + 2Y(g) ![]() 3Z(g)
3Z(g)
第一次平衡(mol): 0.9 1.8 0.3
加入1molZ: 0.9 1.8 1.3
转化: b 2b 3b
第二次平衡(mol):0.9+b 1.8+2b 1.3-3b
各物质含量不变,所以(0.9+b):(1.8+2b):(1.3-3b)=30%:60%:10%=3:6:1,b=0.3,n(Z)=(1.3-0.9)mol=0.4mol,Z的物质的量浓度=![]() =0.2mol/L,故D错误;故选D。
=0.2mol/L,故D错误;故选D。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.碘升华B.Cl2溶于水C.氯化钠受热熔化D.冰融化成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下, ![]() 化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是
化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是
共价键 |
|
|
|
|
|
| 436 | 157 | 568 | 432 | 298 |
A. ![]()
B. 表中最稳定的共价键是H-F键
C. ![]()
![]()
D. ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将碘水中的碘萃取出来,下列萃取剂不能选用的是( )
①乙醇 ②四氯化碳 ③苯 ④己烷 ⑤己烯
A. ②③④ B. ①④ C. ①⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行反应:![]()
![]() 。下列分析正确的是
。下列分析正确的是
A. 平衡后加入![]() ,该反应的
,该反应的![]() 增大
增大
B. 平衡后升高温度,平衡常数K变大
C. 平衡后再充入![]() ,达到新平衡时,
,达到新平衡时, ![]() 的百分含量变大
的百分含量变大
D. 若反应前充入的![]() 与
与![]() 物质的量相等,达平衡时
物质的量相等,达平衡时![]() 的转化率比
的转化率比![]() 的高
的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
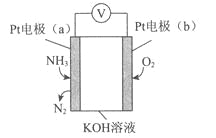
A. 溶液中OH-向电极a移动
B. O2在电极b上发生还原反应
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 电极a的反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) △H=+133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H=+133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a. 从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b. 在平衡体系中增加水的用量可使该反应的平衡常数增大
c. 降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气。
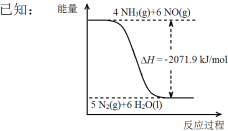
结合①中信息,尿素还原NO(g)的热化学方程式是 。
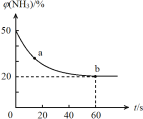
③密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率v正(CO2) b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率v正(CO2) b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 ( )
A. 能使紫色石蕊试液变红的溶液:Mg2+、Na+、NO3-、Cl-
B. 0.1 mol·L-1 NH4Cl溶液:Na+、Ca2+、OH-、CO32-
C. 0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、I-
D. 与Al反应能产生H2的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com