
����Ŀ��̼����Ԫ��������������������������������������
I.�ȵĻ��������ɡ�ת��һֱ����ѧ�о����ȵ���
��1��һ����������������������Ӧ�����Ʊ���̬�Ȱ���NH2Cl������֪���ֻ�ѧ���ļ���:
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
��������Ӧ���Ȼ�ѧ����ʽΪ:__________________��
��2��������һ�ֳ�Ч���ͺ��������������������־õ�ɱ������������ɱ��H7N9�����в�����������ԭ��Ϊ��ˮ������Ӧ����ǿ�����Ե��������÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
II.̼�Ļ������ת���������������о�����Ҫ��Ӧ�����ر���CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���塣
��3��������������Ϊ1L���ܱ��������Բ�ͬ����̼��![]() ����H2��CO2����һ�������·�����Ӧ��2CO2(g)+6H2(g)
����H2��CO2����һ�������·�����Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ�������¡�2.0�ֱ����������̼��ʱ�ı仯���ߣ���
C2H4(g)+4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ�������¡�2.0�ֱ����������̼��ʱ�ı仯���ߣ���
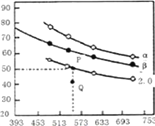
��ش���������:
����Ӧ����H______0����̼����____�£�Q��v(��)_____v(��)���>����<������=����
������ʼʱ��CO2��Ũ���ֱ�Ϊ0.5mol/L���tP���Ӧ�¶��ȵ�ƽ�ⳣ����ֵΪ________��
��4����֪��̼�� H2CO3: K1=4.3��10-7��K2=5.6��10-11��
���� H2C2O4: K1=6.0��10-2��K2=6.0��10-5
�� ���������Դ����������_______(����ĸ)��
a.CO32-��HC2O4- b.H2CO3��C2O42- c. C2O42-��HCO3- d.H2C2O4��HCO3-
�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ����������(��OH-��)Ũ���ɴ�С��˳����_________��
���𰸡� NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ��H=+11.3kJ��mol-1 NH2Cl+H2O=NH3+HClO��NH2Cl+2H2O=NH3��H2O+HClO < > > 512 b c c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-)
��������I����1��һ�������£������백����Ӧ�����Ȱ�(NH2C1)��HCl���壬�仯ѧ����ʽΪ��NH3+Cl2=NH2Cl+HCl����Ӧʱ�ɼ��Ķ�����Ҫ���ȣ��γ��µĻ�ѧ�����ȣ�����ݻ�ѧ���ļ��ܿ�֪��H=3��391.3 kJ/mol+243.0kJ/mol-2��391.3 kJ/mol-191.2kJ/mol-431.8 kJ/mol =+11.3kJ/mol����������Ӧ���Ȼ�ѧ����ʽΪ��NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ��H=+11.3kJ/mol����2���Ȱ���ˮ������ӦNH2-��ˮ���������H+��ϳɰ�����Cl+��OH-�������ǿ�����Ե�����HClO���÷�Ӧ�Ļ�ѧ����ʽΪNH2Cl+ H2O![]() NH3+HClO��NH2Cl+ 2H2O
NH3+HClO��NH2Cl+ 2H2O![]() NH3��H2O +HClO����3������ͼ���֪�������¶ȵ�����CO2��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�����ƶ����淴Ӧ�������ȣ�����Ӧ������ȣ���HС��0����̼��Խ��CO2��ת����Խ����ͼ���֪����̼��
NH3��H2O +HClO����3������ͼ���֪�������¶ȵ�����CO2��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�����ƶ����淴Ӧ�������ȣ�����Ӧ������ȣ���HС��0����̼��Խ��CO2��ת����Խ����ͼ���֪����̼��![]() ������̼��Ϊ2.0ʱ��Q���CO2��ת����С��P�㣬��Ӧ��������ҽ��У��ﵽƽ�⣬v(��)����v(��)����P��CO2��ƽ��ת����Ϊ50%��ƽ��ʱCO2��H2��C2H4��H2O��Ũ�ȷֱ�Ϊ0.25mol/L��0.25mol/L��0.125mol/L��0.5mol/L����ʱ
������̼��Ϊ2.0ʱ��Q���CO2��ת����С��P�㣬��Ӧ��������ҽ��У��ﵽƽ�⣬v(��)����v(��)����P��CO2��ƽ��ת����Ϊ50%��ƽ��ʱCO2��H2��C2H4��H2O��Ũ�ȷֱ�Ϊ0.25mol/L��0.25mol/L��0.125mol/L��0.5mol/L����ʱ![]() ����4���ٸ���̼��Ͳ���ĵ���ƽ�ⳣ����֪�����ԣ�H2C2O4> HC2O4- > H2CO3> HCO3-��a.CO32-��HC2O4-��Ӧ����HCO3-��C2O42-�����ܴ������棻b.H2CO3��C2O42-����Ӧ���ܴ������棻c. C2O42-��HCO3-����Ӧ���ܴ������棻d.H2C2O4��HCO3-��Ӧ����HC2O4-��CO2��H2O�����ܴ������棬��ѡbc���ڶ�Ԫ�����һ������ȵڶ�������ǿ�ö࣬����̼��Ͳ���ĵ���ƽ�ⳣ����֪�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ��������Ũ�������ĵڶ��������̼��ĵ�һ������̶ȴʸ�������(��OH����)Ũ���ɴ�С��˳���ǣ�c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-)��
����4���ٸ���̼��Ͳ���ĵ���ƽ�ⳣ����֪�����ԣ�H2C2O4> HC2O4- > H2CO3> HCO3-��a.CO32-��HC2O4-��Ӧ����HCO3-��C2O42-�����ܴ������棻b.H2CO3��C2O42-����Ӧ���ܴ������棻c. C2O42-��HCO3-����Ӧ���ܴ������棻d.H2C2O4��HCO3-��Ӧ����HC2O4-��CO2��H2O�����ܴ������棬��ѡbc���ڶ�Ԫ�����һ������ȵڶ�������ǿ�ö࣬����̼��Ͳ���ĵ���ƽ�ⳣ����֪�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ��������Ũ�������ĵڶ��������̼��ĵ�һ������̶ȴʸ�������(��OH����)Ũ���ɴ�С��˳���ǣ�c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�� ���� �� ���� �� �ܽ� �� ������ƿת��Һ��
A. ������ B. ������ C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ģ���Ҫ�������£�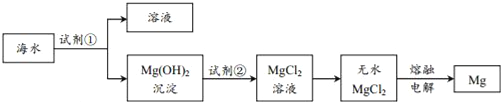
����˵������ȷ���ǣ� ��
A. Ϊʹ��ˮ�е�MgSO4ת����Mg��OH��2���Լ��ٿ�ѡ��ʯ����
B. �����Լ��ٺ���õ�Mg��OH��2�����ķ����ǹ���
C. �����Լ��ڷ�Ӧ�����ӷ���ʽΪ��OH��+H+=H2O
D. ͨ��������ڵ���ˮMgCl2�õ�48gMg����ת��4mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵı��淽���У�������ǣ�
A. �����Ҫ����������ƿ��
B. ���Ƶ���ˮҪ��������ɫϸ��ƿ�У���������������
C. ����Һ��Ҫ�����ڴ�����������ɫϸ��ƿ�У�����Һ�������ˮ��
D. ���ʵ�Ҫ��������ɫ���ƿ�У���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ij�ݻ�Ϊ2L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯����������ͼ����ͼ��ʾ��
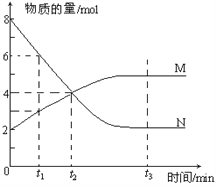
��1���÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2����ͼ����ʾ������ʱ���У�_____����t1��t2��t3��ʱ�̴���ƽ��״̬����ʱV��____V�����������=�������ﵽƽ��״̬��ƽ����Ӧ����v(N)�sv(M)= _____��
��3������Ӧ�������ݻ����䣬��ѹǿ���ٸı䡱_______����ܡ����ܡ�����Ϊ�÷�Ӧ�Ѵﵽƽ��״̬���ж����ݡ�
��4����֪M��N��Ϊ���壬�����д�ʩ������Ӧ���ʵ���_____��ѡ����ĸ����
A�������¶� B������ѹǿ C����СM��Ũ�� D������Ӧ���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�0.200 molL-1��HA��Һ��0.200 molL-1��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ�����±�������˵����ȷ����
�� | X | Y | Na+ | A- |
Ũ��/��mol��L-1�� | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol��L-1HA��Һ��pH=1 B. ���¶���Kw=1.0![]() 10-14
10-14
C. ��X��ʾOH-��Y��ʾH+ D. �����Һ�У�n��A-��+n��X��=n��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о�֪Cu2����H2O2�ֽ�Ҳ���д����ã�Ϊ�Ƚ�Fe3����Cu2����H2O2�ֽ�Ĵ�Ч����ij�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣�ش�������⣺

(1)���Է�����
����ͼ��ͨ���۲�_____________________________________�����ԱȽϵó����ۡ�
����ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ��������������__________________��
����H2O2�ڶ������̴������·�����Ӧ��������������MnO3���֣�д��������Ӧ���̵�������ѧ����ʽ��___________________________��________________________��
(2)������������ͼ����ʾ��ʵ��ʱ��������40 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԡ�ͼ������A������Ϊ________��ʵ������Ҫ������������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ŀ�ĵ����������������е�һ�ֶԲ������п�ʴ���Ƴɵģ�����������
A. ���� B. �ռ� C. ���� D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֹ�ҵ�Σ������ʳ�ηdz����ƣ����Խ�ǿ��ij��ѧ��ȤС���ʳ�����������ƽ���̽����
��. ����NaCl��NaNO2
��ͬѧ�ó���������
���飺������Ksp(AgNO2)=2��10-8��Ksp(AgCl)=1.8��10-10���ֱ���ʢ��5mL0.0001mol/L��������Һ���Թ���ͬʱ��εμ�0.0001mol/L��������Һ�������ɳ�������װ��_____________��Һ���Թܡ�
��ͬѧ�ⶨ��ҺpH
��pH��ֽ�ֱ�ⶨ0.1mol/L��������Һ��pH�����NaNO2��Һ�ʼ��ԡ�����Һ�ʼ��Ե�ԭ����__________�������ӷ���ʽ���ͣ���
��. ��ͼ����ʵ���ҽ��ж��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������
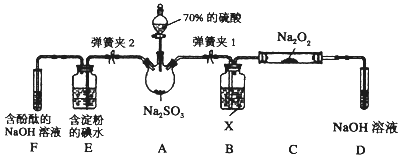
��1��װ��B���Լ�X��_______��װ��D��ʢ��NaOH��Һ��������_______________________��
��2���رյ��ɼ�2�����ɼ�1��ע����������û������ƿ�й��壬����SO2��Na2O2��Ӧ�Ƿ����������ɵķ�����_____________________________________��
��3���رյ��ɼ�1���ɼ�2�������������E��F�У���˵��I����ԭ������SO2������Ϊ______________��������Ӧ�����ӷ���ʽ��_____________________��
��. �õ绯ѧ��ģ�ҵ����SO2�������Ṥҵβ���е�SO2ͨ����ͼװ�ã��缫��Ϊ���Բ��ϣ�����ʵ�飬�������Ʊ����ᣬͬʱ��õ��ܣ�
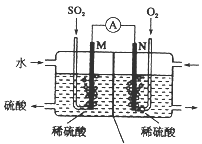
��1��M�������ĵ缫��ӦʽΪ____________________________��
��2����ʹ��װ�õĵ���ǿ�ȴﵽ2.0 A��������ÿ����Ӧ��ͨ���״������������Ϊ_____L����֪��1��e��������Ϊ1.6��10��19C����(������λ��Ч����)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com