
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

分析 (1)①设反应了CO2x,列三段式,根据体积分数计算x,代入化学平衡常数计算;
②已知:ⅠCH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
ⅡCO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
Ⅲ2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
由盖斯定律Ⅰ+Ⅱ×2-Ⅲ×2可得CO2(g)+CH4(g)?2CO(g)+2H2(g),据此计算;
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大;
③先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
(3)①二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关;
②根据题干信息,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒进行解答;
(4)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子.
解答 解:(1)①250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,反应了CO2x:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
n始:6 6 0 0
n转:x x 2x 2x
n平:6-x 6-x 2x 2x
由CO2的体积分数为0.1,则$\frac{6-x}{6-x+6-x+2x+2x}$=0.1,解得x=4,则K=$\frac{(8mol÷4L)^{4}}{(2mol÷4L)^{2}}$=64;
故答案为:64;
②已知:ⅠCH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
ⅡCO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
Ⅲ2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
由盖斯定律Ⅰ+Ⅱ×2-Ⅲ×2可得CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1;
故答案为:+247.3 kJ•mol-1;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
故答案:温度超过250℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大;
故答案为:增大反应压强、增大CO2的浓度;
③Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;
b.Li2O、Na2O、MgO均能吸收CO2,钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
故答案为:ab;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4$?_{700℃}^{500℃}$ Li2CO3+Li2SiO3;
故答案为:CO2+Li4SiO4$?_{700℃}^{500℃}$ Li2CO3+Li2SiO3;
(4)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-;
故答案为:CO2+2e-═CO+O2-.
点评 本题考查了综合利用CO2,涉及盖斯定律以及化学反应常数、化学平衡以及原电池原理的运用,难度中等,掌握基础,分析题目信息,根据所学知识即可完成.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、MnO2 | B. | C、FeS | C. | Si、FeO | D. | CuO、Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
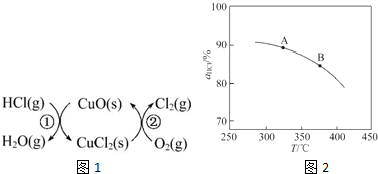
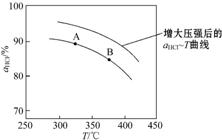 ,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)?2SO3(g);△H=-2a KJ/mol | B. | 2SO2(g)+O2(g)2?SO3(g);△H=-a KJ/mol | ||
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=a KJ/mol | D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-2a KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com