
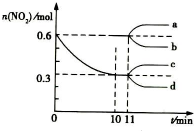
 汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示
汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示分析 ①分析图象变化量,计算一氧化碳的反应速率,结合反应速率之比等于系数之比计算得到一氧化碳的速率,依据化学反应速率概念计算得到,缩体积,增大压强,平衡向正反应移动,改变瞬间n(NO2)不变,达平衡是n(NO2)减小;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①V(CO)=$\frac{4}{2}$V(NO2)=2×$\frac{\frac{0.6mol-0.3mol}{2L}}{10min}$=0.03mol/L•min,从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间NO2物质的量不变,随平衡正向进行,NO2物质的量减小,则n(NO2)的变化曲线
d符合;
故答案为:0.03mol/L•min;d;
②A.容器内混合气体颜色不再变化,说明二氧化氮的浓度不变反应达平衡状态,故正确;
B.容器内的压强保持不变,说明气体的物质的量不变,反应达平衡状态,故正确;
C.容器内混合气体密度始终保持不变,故错误;
故选C.
点评 本题考查了化学反应的速率和化学平衡影响因素的分析判断,图象分析和平衡状态的判断是解题关键,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g) 不能自发进行,则该反应的△H>0 | |
| B. | 25℃时,向0.1 mol•L-1CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | Ba的金属活动性强于Mg,可以通过电解BaCl2溶液的方法获得金属钡 | |
| D. | 对硫酸工业中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 向Cu粉中加入过量的浓HNO3:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氯化铵溶液显酸性的原因:NH4++OH-=NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入CaCl2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | SO2通入Na2S溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
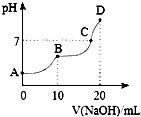 25℃时,向10mL 0.1mol•L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是( )
25℃时,向10mL 0.1mol•L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是( )| A. | C点溶液中含有NaHC2O4和Na2C2O4 | |
| B. | NaHC2O4溶液中水的电离程度比Na2C2O4溶液中小 | |
| C. | B点,c (Na+)=2[c (H2C2O4)+c (HC2O4-)+c (C2O42-)] | |
| D. | D点,c (Na+)>c (C2O42-)>c (OH-)>c (HC2O4-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | A装置中K+移向VB2电极 | |
| D. | b装置内收集的0.448L气体(标准状况)全部为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com