
【题目】已知:FeCl3(aq)+3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
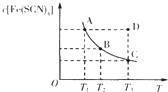
A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有υ(正)<υ(逆)
D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X元素的名称:X____,Y元素在元素周期表中的位置____,Z元素的原子结构示意图_______。
(2)用电子式表示ZX2的形成过程_____。
(3)Y2X对应水化物的电子式_____,其中存在的化学键有_____。
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式_______。
(5)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:
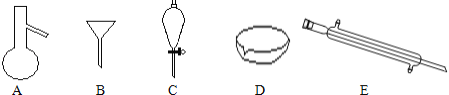
(1)写出仪器C的名称___。
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:___;②花生油和水:___。
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体___色,下层液体___色。
(4)溴单质和碘单质有相类似的性质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:___。
A.汽油 B.CCl4 C.酒精 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2≒2C的反应来说,以下化学反应速率的表示中,反应速率最慢的是
A.v(B2)=0.8mol/(Ls);B.v(A2)=0.4mol/(Ls);
C.v(C)=0.6mol/(Ls);D.v(B2)=4.2mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图,

(1)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为_________,写出正极的电极反应式______________;
(2)若A为铜片,B为银片,电解质为AgNO3溶液,则银片为______________极(填正或负),写出电极反应式:负极______________,正极______________
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,该燃料电池的总反应为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
选项 | A | B | C | D |
实验目的 | 除去KCl中少量的MnO2 | 用10mol·L-1的盐酸配制100mL0.1 mol·L-1的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同化学键的表示,回答下列问题:
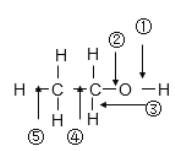
(1)乙醇与金属钠反应,___________键断裂
(2)将乙醇与浓硫酸的混合液,温度升高到170℃时,_________键断裂
(3)将乙醇与浓硫酸的混合液,温度升高到140℃时,_________键断裂
(4)在加热条件下,用铜作催化剂与氧气反应时,______断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。实验室用大理石(主要成分为CaCO3,另外有少量的含硫化合物)和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
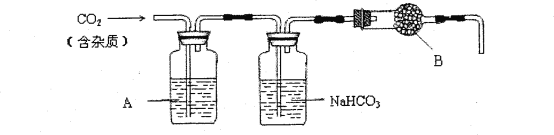
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L—1),应选用的仪器是____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
上述装置中,A是___溶液,NaHCO3溶液可以吸收____。上述装置中,B物质是____。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。
(2)SiO2与CO2组成相似,但固体的熔点相差甚大,其原因是_____。
(3)饱和的Na2CO3溶液中通入过量CO2的离子方程式为_____。0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=_____,其中有关碳微粒的关系为:____ =0.1mol/L。浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中离子浓度由大到小的关系为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com