
卫生部发出公告,自2012年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )。
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1∶1
C.CaO2与水反应时,每产生1 mol O2转移电子4 mol
D.CaO2与CO2反应的化学方程式为2CaO2+2CO2===2CaCO3+O2
科目:高中化学 来源: 题型:
能源问题是现代社会发展的三大基本问题之一,能源家族中:①煤炭、②核能、③石油、④天然气、⑤水能、⑥风能、⑦地热能等,属于不可再生的是________(填序号,下同);属于新能源的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
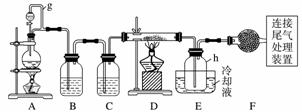
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:________________________________________________________________________。
(2)装置A中g管的作用是____________;装置C中的试剂是__________;装置E中的h瓶需要冷却的理由是_______________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________________(填写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为 ( )。
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO +OH-===CO
+OH-===CO +H2O
+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+OH-===SO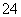 +Cl-+H2O
+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+===H2S↑+Ba2+
D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-+H2O===
2[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH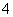 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO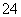 、NO
、NO 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)D的化学式是______,判断理由是__________________________________________________
__________________________________________________。
(2)写出其余几种物质的化学式:A____________________,B____________________,C____________________。
(3)写出实验②中有关反应的离子方程式__________________________________________________
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3—→N2O3+H2O
②NH3+NO—→HNO2+H2O
③N2O4+H2O—→HNO3+HNO2
其中你认为一定不可能实现的是________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______。
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的________作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因:________________________________________________________________________
________________________________________________________________________。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份________________________________________________________________________;
第二份________________________________________________________________________。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为________________________________________________________________________。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com