
【题目】下列关于苯的叙述不正确的是( )
A. 苯是无色、带有特殊气味的液体
B. 苯分子中键与键的夹角是120°
C. 苯在一定条件下能与溴发生取代反应
D. 苯中不含碳碳双键,所以不可能发生加成反应
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
①已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动(填“向左”“向右”或“不”)。

(2)在相同温度下,两个体积均为1L的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号 | 起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO催化转化进行研究。测得NO转化为N2的转化率随温度CO混存量的变化情况如图所示。

①在n(NO)/n(CO)=1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可以发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列烃命名:
(1) ____。
____。
(2) ____。
____。
(3)![]() ____。
____。
(4)有机化合物 的名称为____或____。
的名称为____或____。
(5)2,4二甲基2己烯写出结构简式____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是

A. 曲线 M 表示 pH与![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-2.7
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭气缸中用一不漏气的可自由移动的活塞隔开(如下图),右边充有H2和O2,左边充有N2,在20℃时将右边的混合气体点燃,冷却到原温度。若活塞原来距离气缸左端的距离为总长的1/4,反应后活塞静止于气缸中点(水的体积忽略不计),则原来H2和O2的体积比可能为( )
![]()
A. 2:1 B. 7:2 C. 5:4 D. 8:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
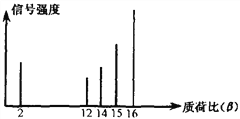

A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)在现代化学中,常利用______上的特征谱线来鉴定元素,称为光谱分析。
(2)写出 Cu2+的外围电子排布式__________;比较铁与锰的第三电离能(I3):铁____锰(填“>”、 “=”或“<”),原因是________________。
(3)已知 [Zn(CN)4]2-与甲醛在水溶液中发生反应可生成一种新物质 HOCH2CN,试判断新物质中碳原子的杂化方式___________;1mol[Zn(CN)4]2-中的 σ 键数为__________。
(4)如图是晶体 Fe3O4 的晶胞,该晶体是一种磁性材料, 能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释 Fe3O4 晶体能导电的原因_________________;若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g·cm-3(阿伏加德罗常数用 NA 表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com