
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
【答案】温度计 环形玻璃搅拌棒 为了使HCl尽可能的反应完全 NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1 无 有 上下抽动环形玻璃搅拌棒
【解析】
(1)根据中和热的测定装置,实验尚缺少的玻璃用品是环形玻璃搅拌棒、温度计。
(2)NaOH用量比HCl用量稍多的原因是:为了使HCl尽可能的反应完全。
(3)实验中生成H2O的物质的量为n(H2O)=n(HCl)=0.5mol/L×0.05L=0.025mol;第①组实验的t2-t1=23.3℃-20℃=3.3℃,第②组实验的t2-t1=23.5℃-20℃=3.5℃,两组实验的t2-t1的平均值为(3.3℃+3.5℃)÷2=3.4℃,实验过程中放出的热量Q=4.18kJ·℃-1·kg-1×(1g·cm-3×50mL+1g·cm-3×50mL)×10-3kg/g×3.4℃=1.4212kJ;中和热ΔH=-![]() =-56.8kJ/mol;NaOH溶液与HCl反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-56.8kJ/mol。
=-56.8kJ/mol;NaOH溶液与HCl反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-56.8kJ/mol。
(4)KOH和NaOH都属于一元强碱,若用KOH代替NaOH,对测定结果无影响。醋酸属于弱酸,弱酸的电离是吸热过程,若用醋酸代替盐酸做实验,对测定结果有影响,使ΔH的绝对值偏小。
(5)为了减少热量的散失,两溶液混合后,搅拌溶液的方法是:轻轻上下抽动环形玻璃搅拌棒。


科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列说法正确的是( )
A.CO2属于大气污染物B.酸雨是pH小于7的雨水
C.将电器垃圾深埋处理,可减少重金属污染D.大雾是一种胶体,能发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖。据报道,江苏在最近50年里平均气温升高1.38℃。下列哪种气体的增加是导致这种情况出现的主要原因
A. N2 B. O2 C. CO2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的记录正确的是 ( )
A. ①②③ B. ①②④ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是

A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中的电解液为蒸馏水
D. 若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出配平的该反应的化学方程式:_______________
②被氧化的元素是___________
(2)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+==Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①写出CuH在氯气中燃烧的化学反应方程式:___________________________________.
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________.
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
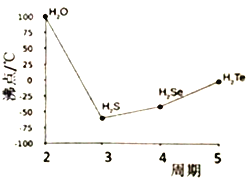
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com