
 我国在青藏高原发现了名为“可燃冰”的环保型新能源.?
我国在青藏高原发现了名为“可燃冰”的环保型新能源.?分析 (1)①Cl-Cl→2Cl△H=243kJ•mol-1
②Cl•+CH3-H→CH3+H-Cl△H=4kJ•mol-1
③•CH3+Cl-Cl→CH3--Cl+Cl•△H=-106kJ•mol-1 ;
依据盖斯定律②+③计算得到;
(2)燃料电池中燃料在负极失电子发生氧化反应,正极是氧气得到电子发生还原反应.
解答 解:(1)①Cl-Cl→2Cl△H=243kJ•mol-1
②Cl•+CH3-H→CH3+H-Cl△H=4kJ•mol-1
③•CH3+Cl-Cl→CH3-Cl+Cl•△H=-106kJ•mol-1 ;
依据盖斯定律②+③得到:CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g)△H=-102 kJ•mol-1;
故答案为:CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g)△H=-102 kJ•mol-1;
(2)甲烷燃料电池,燃料电池中燃料甲烷在负极失电子发生氧化反应,电解质溶液是氢氧化钾溶液,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O;
故答案为:负极; CH4-8e-+10OH-=CO32-+7H2O.
点评 本题考查了热化学方程式和盖斯定律的应用,原电池的电极反应分析,注意燃料电池电解质溶液的酸碱性,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都增大 | B. | 正反应速率减小,逆反应速率增大 | ||
| C. | 平衡向逆反应方向移动 | D. | 混合气体中SO2的体积百分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
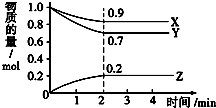 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 温度越高,KW越大 | |
| B. | 温度越低,KW越大 | |
| C. | 随着温度的升高,KW可能增大也可能减小 | |
| D. | 随着温度的升高,KW肯定增大,H+和OH-浓度同时升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com